欧阳号锋,易少奎,张龙,杨思琦,李艳和,3
1.华中农业大学水产学院/农业农村部淡水动物育种重点实验室,武汉 430070;
2.湖州师范学院生命科学学院,湖州 313000;
3.教育部长江经济带大宗水生生物产业绿色发展工程研究中心,武汉 430070
硫酸软骨素(chondroitin sulfate,CS)作为一种天然的酸性粘多糖,参与多种生理过程的调控,在细胞黏附、形态发生、神经网络形成和细胞分裂方面能够发挥特定的生物学功能[1]。此外,CS具有一定抗炎活性[2]。硫酸软骨素N-乙酰半乳糖胺基转移酶-1(CSGalNAcT-1)是硫酸软骨素生物合成中的关键糖基转移酶,该酶被认为在硫酸软骨素生物合成中发挥重要作用,并且在软骨细胞外基质退化中同样发挥重要作用[3-4],在抑制丙型肝炎病毒复制方面也发挥着关键作用[5]。CSGalNAcT-1不仅对于软骨的正常发育至关重要,在免疫系统中亦可能发挥着的重要的作用。到目前为止,CSGalNAcT-1在甲壳动物的免疫功能方面的研究很少。本研究以无脊椎动物先天免疫分子机制的模型生物克氏原螯虾作为研究对象,利用RACE技术成功克隆得到克氏原螯虾CSGalNAcT-1基因cDNA全长序列,并进一步研究了CSGalNAcT-1基因在克氏原螯虾组织中的差异性表达,同时探究了克氏原螯虾在受到CpG寡脱氧核苷酸(ODN)、嗜水气单胞菌(Aeromonas hydrophila)和白斑综合征病毒(white spot syndrome virus,WSSV)刺激后,肝胰腺、鳃、皮肤、胃、肌肉、肠道和血细胞7个组织中CSGalNAcT-1基因的相对表达量变化,旨在为探索CSGalNAcT-1在克氏原螯虾以及其他甲壳动物免疫反应中的作用提供参考。
1.1 试验材料
试验用克氏原螯虾采集于湖北省潜江市某人工养殖基地,体质量15~25 g,暂养于室内的塑料盒中,水温控制在25~28℃,充氧,投喂小龙虾人工配合饲料,每天早晚各1次。选取健康活力强的克氏原螯虾个体120尾,均分为4组,养殖在4个塑料盒中至少7 d以适应试验环境。试验期间每天投喂1次。
另采集3尾健康虾的中肠、近胃段肠、卵巢、鳃、后肠、食道下神经节、脑、腹部腹神经索、胸部腹神经索、皮下组织、血细胞、肝胰脏、输精管、促雄性腺、眼柄、心脏、胃、肌肉和围食道神经节等19个组织的样品,迅速置于液氮速冻,存放于-80℃冰箱备用。
1.2 克氏原螯虾CSGalNAcT-1基因全长cDNA克隆
取肠道组织进行研磨,采用TRIzol Reagent(Thermo Scientific,USA)法根据说明书进行总RNA的提取。使用紫外分光光度计(Thermo Scientific,USA)检测其质量与浓度。使用ReverAid First Strand cDNA Synthesis Kit(Thermo Scientific,USA)根据说明书进行反转录以获得cDNA第一链。
基于NCBI中已知无脊椎动物的CSGalNAcT-1基因序列的保守区域,设计简并引物(CSG-J-F/R),采用PCR扩增获得克氏原螯虾CSGalNAcT-1基因的cDNA部分片段(表1)。PCR反应体系为:0.5 μL cDNA模板、1 μL 10×反应缓冲液、0.2 μL dNTP(10 mmol/L)、上下游引物(10 μmol/L)各0.1 μL、0.1 μLTaqDNA聚合酶(5 U/μL)、8 μL ddH2O;
PCR反应条件为:95℃预变性5 min;
95℃变性30 s,57.2℃退火45 s,72℃延伸2 min,35个循环,最后72℃延伸10 min,4℃保存。

表1 所用引物序列Table 1 The sequences of the primers used
根据获得的CSGalNAcT-1基因的部分cDNA序列来设计 5′RACE 引物(B695-1(GSP1)、B695-2(GSP2)、B695-3(GSP3))和3′RACE引物(C468-1、C468-2)(表1)。使用 SMARTerTMRACE cDNA Amplification Kit(Clontech,,China)试剂盒,按照说明书以获取5′末端以及3′末端序列。
1.3 克氏原螯虾CSGalNAcT-1基因组织表达分析
克氏原螯虾19个组织样品采用本文材料与方法“1.2”中的方法获得cDNA第一链。在QuantStudio Realtime Lightcycler仪器上进行荧光定量PCR(qRT-PCR),采用20 μL qRT-PCR体系:TB Green Premix ExTaq Ⅱ(TaKaRa,China)10 μL,正/反向引物(CSG-q-F/R)各 0.2 μL(10 μmol/L),cDNA 模板1 μL,ddH2O 8.6 μL。PCR扩增条件为:95 ℃预变性5 min,然后 95℃ 30 s,最适温度(64.5℃)30 s,72℃30 s,循环40次。管家基因18s-RNA用作内参基因,并在相同的条件下进行扩增。每个样品设置3个重复,并通过熔解曲线以及比较阈值(Ct)法来确定PCR反应的特异性。
1.4 不同刺激物刺激后克氏原螯虾CSGalNAcT-1基因表达变化
1)不同刺激物刺激实验。向3个试验组的克氏原螯虾个体分别注射免疫增强剂CpG ODN、WSSV和嗜水气单胞菌,对照组克氏原螯虾个体注射生理盐水。注射实验所用的ODN由擎科生物科技有限公司合成,直接用蒸馏水稀释后使用,质量浓度为0.5 mg/mL;
WSSV浓度为9.7×108拷贝数/mL;
嗜水气单胞菌浓度为107CFU/mL。采用肌肉注射,注射量为0.1 mL。
2)不同刺激物刺激后CSGalNAcT-1基因在克氏原螯虾各组织中的表达检测。在注射后6、12、24、48、96 h,每组分别取3尾虾,取其肝胰腺、鳃、皮肤、胃、肌肉、肠道组织放置于冻存管内,迅速置于液氮冷冻后放入-80℃冰箱保存。使用装有抗凝剂的1 mL注射器从虾体的围心腔内采集血液,4 000 r/min 4℃离心15 min,去上清液,保留血细胞,并迅速置于液氮中冷冻后放入-80℃冰箱保存。按照本文材料与方法“1.2”所述方法进行总RNA的提取、cDNA模板的合成,以及采用荧光定量PCR检测克氏原螯虾受到不同刺激物刺激后CSGalNAcT-1基因在各组织中的表达变化情况。
1.5 序列分析与数据处理
利用DNAMAN软件将3′末端和5′末端序列与已获得的中间序列进行拼接、验证,得到CSGalNAcT-1基因的cDNA序列全长。利用NCBI中的BLASTX 与 BLASTP(https://blast.ncbi.nlm.nih.gov/Blast.cgi)在线搜索工具对该基因的cDNA序列进行比对;
使用 ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder)在线软件预测CSGalNAcT-1基因序列的开放阅读框;
利用SignalP5.0(http://www.cbs.dtu.dk/services/SignalP)预测CSGalNAcT-1基因编码氨基酸的信号肽;
利用ExPASy(https://web.expasy.org/protparam)及SMART(http://smart.embl-heidelberg.de)分别预测氨基酸的理化性质和保守结构域。使用DNAMAN软件中多序列比对方法,对不同鱼类的CSGalNAcT-1氨基酸序列进行同源性分析;
使用MEGA 5.1软件中邻接法(neighborjoining)对不同鱼类CSGalNAcT-1氨基酸序列进行系统发育分析,构建克氏原螯虾CSGalNAcT-1基因系统发育树,自展值设为1 000。
采用2-ΔΔCt方法计算CSGalNAcT-1基因的相对表达量,试验数据通过SPSS 21.0软件进行单因素方差分析(One-way ANOVA),并选择Duncan’s多重检验,进行差异显著性分析,P<0.05则表示差异显著。所得数据结果用“平均值±标准差”(Mean±SD)表示。
2.1 CSGalNAcT-1基因全长及序列分析
通过RACE技术获得了克氏原螯虾1 956 bp的CSGalNAcT-1基因序列全长(GenBank登录号:MT311699)。该基因序列包含1个长为1 608 bp的开放阅读框(ORF),1个长度为104 bp的5′非翻译区(UTR)和1个长度为244 bp的3′非翻译区;
共编码535个氨基酸,预测分子质量为60 186.46 u,理论等电点为6.73,不存在跨膜位点(图1)。CSGalNAcT-1中存在GT-A家族2个保守的典型结构域(CHGN和glyco_trans_7c)。CSGalNAcT-1中存在1个DXD基序,在许多糖基转移酶中保守,是二价阳离子结合的关键序列,CSGalNAcT-1中也存在1个GWGGED基序,在部分β4GalT家族中高度保守(图1)。氨基酸序列同源性分析显示,克氏原螯虾CSGalNAcT-1氨基酸序列与南美白对虾(Penaeus vannamei)相似性最高(87.64%)(图2A)。系统进化树结果显示,克氏原螯虾与南美白对虾聚为一支(图2B),亲缘关系最近,与传统分类基本一致。

图1 CSGalNAcT-1的核苷酸序列及推导的氨基酸序列Fig.1 Nucleotide sequence and deduced amino acids sequence of CSGalNAcT-1
2.2 不同组织CSGalNAcT-1基因的相对表达分析
CSGalNAcT-1基因在克氏原螯虾各组织中的表达分析结果显示,在各个组织中都能够广泛检测到CSGalNAcT-1表达。其中,在中肠(MG)中CSGal-NAcT-1的表达量最高,其次是近胃段肠(FG)、卵巢(Ov)、鳃(Gi)和后肠(HG)。而CSGalNAcT-1在食道下神经节(SG)的表达量比较低;
在脑(Br)、腹部腹神经索(VG)、胸部腹神经索(TG)、皮下组织(Hy)、血细胞(Hem)、肝胰脏(Hep)和输精管(TD)的表达量更低;
在促雄性腺(AG)、眼柄(Es)、心脏(Hea)、胃(St)、肌肉(Mu)和围食道神经节(PN)等组织,CSGalNAcT-1几乎没有表达(图3)。
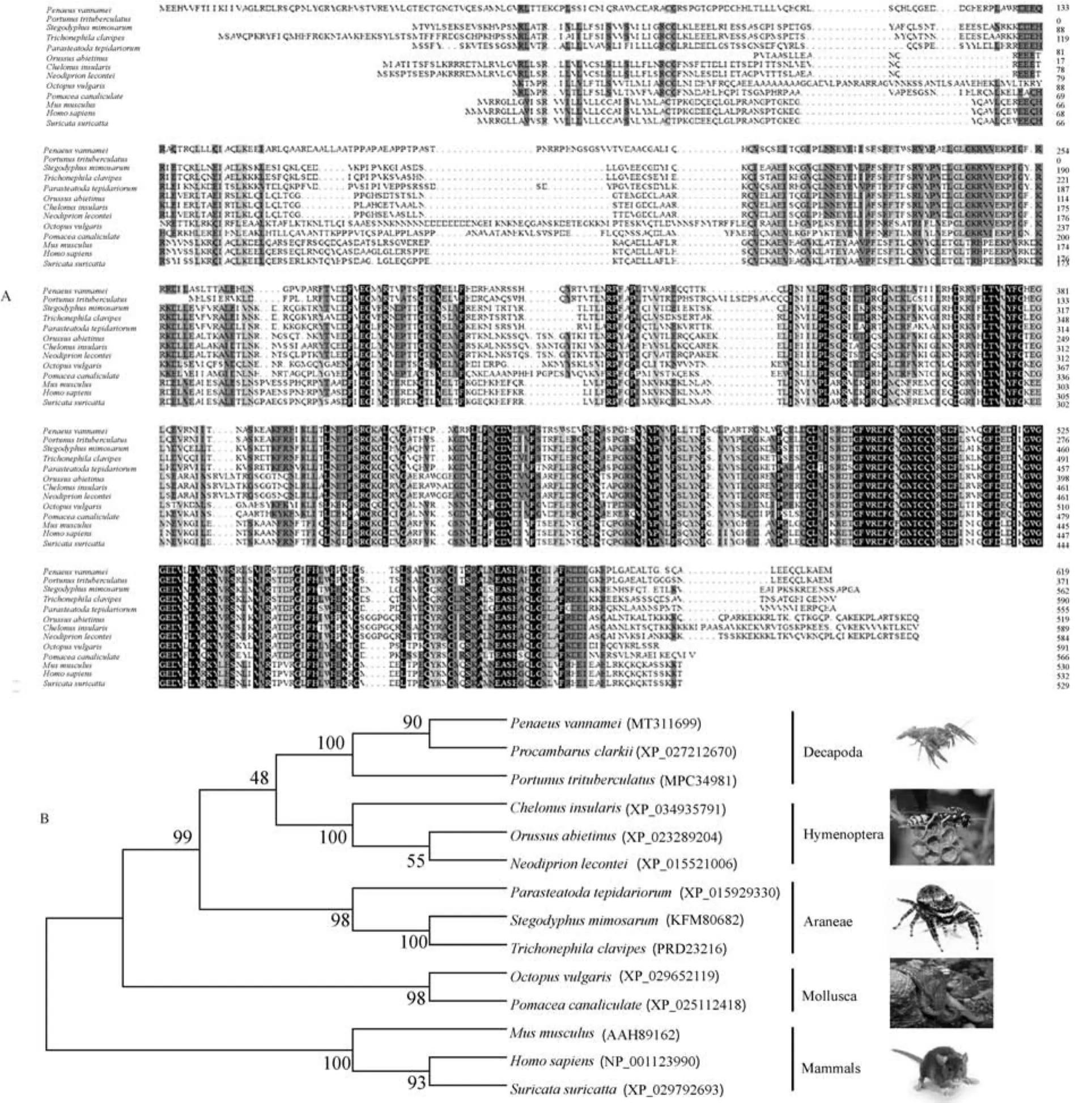
图2 CSGalNAcT-1的多重氨基酸序列比对(A)以及系统发育树(B)Fig.2 Multiple amino acid sequence alignment of CSGalNAcT-1(A)and the neighbor-joining tree constructed(B)

图3 克氏原螯虾CSGalNAcT-1基因在各组织中的表达情况Fig.3 The expression profile of CSGalNAcT-1 in different tissues of Procambarus clarkii
2.3 不同刺激物刺激后CSGalNAcT-1基因的表达变化
检测克氏原螯虾在不同刺激物刺激后CSGalNAcT-1基因的表达变化如图4所示。图4A显示,感染WSSV病毒后,克氏原螯虾肝胰腺中CSGalN-AcT-1的表达水平下调,表达量在感染96 h后达到峰值;
而感染嗜水气单胞菌后12 h肝胰腺中CSGalNAcT-1的表达水平显著上调,表达量在12 h达到最高,为对照组的9.71倍。与对照组相比,注射免疫增强剂CpG ODN后,肝胰腺中CSGalNAcT-1的表达显著上调(图4A)。经WSSV注射感染后,肠道组织中的CSGalNAcT-1基因表达上调,在感染后6 h达到最高水平,为对照组的11.49倍,在感染后96 h恢复到与对照组相同水平。在感染嗜水气单胞菌后,CSGalNAcT-1基因在肠道中的表达水平显著上调,在感染后6 h达到峰值,为对照组的5.54倍(图4F)。注射感染嗜水气单胞菌以及WSSV后,CSGalNAcT-1基因在克氏原螯虾鳃和皮肤组织以及血细胞中的表达量均呈现出上调,在注射免疫增强剂CpG ODN后,CSGalNAcT-1基因的表达量在3个组织中均呈现出增加的趋势,尤其是在血细胞中(图4B、C、G)。

图4 不同刺激物刺激后克氏原螯虾CSGalNAcT-1基因在不同时间点不同组织中的表达情况Fig.4 Expression levels of CSGalNAcT-1 after different pathogen infection in different tissues at different time
本研究克隆获得了克氏原螯虾CSGalNAcT-1基因全长序列,通过生物信息学分析发现氨基酸序列含有DXD和GWGGED 2个基序序列,这与之前研究中对于CSGalNAcT-1的描述一致[6]。氨基酸序列比对分析显示,CSGalNAcT-1氨基酸序列在不同物种间具有高度保守性,与南美白对虾(Penaeus vannamei)(77.24%)和三疣梭子蟹(Portunus trituberculatus)(87.64%)的氨基酸序列同源性最高。系统发育分析结果表明克氏原螯虾与南美白对虾亲缘关系最近,聚为一支。因此,我们可以确定该序列为克氏原螯虾CSGalNAcT-1基因。
CS在各组织和细胞中都能够广泛合成,CSGal-NAcT-1基因同样在各组织中都有广泛表达。CSGalNAcT-1在CS的合成过程中发挥重要作用[7]。与其他CS合成相关的转移酶相比,CSGalNAcT-1基因在鼠软骨的表达量最高,在其他组织中的表达情况与人基本相似[8]。之前研究发现CSGalNAcT-1基因可能参与了克氏原螯虾对WSSV病毒侵染的免疫抵抗[9]。本研究发现CSGalNAcT-1基因在克氏原螯虾的中肠、近胃段肠与卵巢中的表达量高。此外,在哺乳动物(人)中,CSGalNAcT-1基因在甲状腺和胎盘组织中的表达量最高[4,6]。卵巢是重要的生殖相关组织,卵巢内CSGalNAcT-1基因表达量高是否说明该基因在克氏原螯虾的生殖过程中亦发挥了关键作用,有待进一步研究。
与其他甲壳类动物一样,克氏原螯虾不具备获得性免疫,完全依赖先天性免疫来抵抗外界病原入侵[10]。无脊椎动物中,肝胰腺和血细胞[11]是重要免疫器官,本研究中,感染WSSV和嗜水气单胞菌后,CSGalNAcT-1基因在鳃、皮肤和血细胞中的表达呈上调,在肝胰腺中的表达呈下调。推测克氏原螯虾能够通过上调血细胞中CSGalNAcT-1基因的表达以及下调肝胰腺中CSGalNAcT-1基因的表达来抵抗病原入侵,这与人体能够通过下调肝脏中CSGal-NAcT-1基因的表达来抑制丙型肝炎病毒(HCV)的复制的结果类似[5]。CpG ODN是一种免疫刺激剂,能够通过增强B细胞的活性来增强机体的免疫力。本研究中注射CpG ODN后CSGalNAcT-1在克氏原螯虾大部分组织中均表达上调,尤其是在血细胞中,进一步表明了CSGalNAcT-1可能是克氏原螯虾的免疫相关基因。
WSSV病毒侵染会使得克氏原螯虾肠道稳态遭到破坏并导致疾病的发生[12],有研究显示,在感染WSSV后,南美白对虾肠道内气单胞菌属的丰度显著增加[13]。在本研究中,经WSSV与嗜水气单胞菌感染后,CSGalNAcT-1基因在肠道中的表达量在6 h迅速升高,在12 h到48 h均低于对照组,呈现出明显的下调表达。猜测克氏原螯虾可能通过调节肠道中CSGalNAcT-1基因的表达来维持肠道稳态,从而防止虾体患病。CS能够激活JNK通路来调节纤维肉瘤细胞的黏附和迁移[14],JNK通路激活又可以增强抗菌肽产生[15]。有研究显示,病毒侵染后,JNK信号通路参与调节特定病毒蛋白的表达以及能够参与病毒的复制[16]。CSGalNAcT-1作为CS生物合成过程中的关键转移酶是否能够参与JNK信号通路的激活,进而在甲壳类动物免疫防御过程中发挥重要作用,有待进一步研究。CSGalNAcT-1作为硫酸软骨素生物合成的关键糖基转移酶,其在甲壳形成中的作用尚不清楚,探索其在蜕皮过程中的相关作用也将是该基因的研究方向之一。
猜你喜欢 克氏血细胞单胞菌 克氏原螯虾活体运输技术研究进展河北渔业(2022年9期)2022-09-23除草剂敌草快对克氏原螯虾(Procambarus Clarkii)的毒性研究当代水产(2022年6期)2022-06-29临床检验中血细胞形态学观察与分析中国药学药品知识仓库(2022年9期)2022-05-23比较分析切开复位克氏针、螺钉固定治疗小儿肱骨内上髁骨折价值中国典型病例大全(2022年13期)2022-05-10社区管理精神病人全血细胞分析锦州医科大学报(2022年2期)2022-05-07辽中区患病草鱼体内嗜水气单胞菌分离、鉴定与致病力测定当代水产(2022年3期)2022-04-26好好刷牙能防老痴文萃报·周五版(2019年45期)2019-09-10好好刷牙能防老痴华声文萃(2019年12期)2019-09-10免疫球蛋白IgY对牙龈卟啉单胞菌诱导的牙周炎大鼠模型的影响华东师范大学学报(自然科学版)(2019年3期)2019-06-24凡纳滨对虾血细胞数量变化与抗弧菌感染关系研究山东工业技术(2017年5期)2017-03-16