陈少壮 叶岩荣 沈 赟 刘 佳
1.复旦大学附属中山医院厦门医院药剂科,福建 厦门 361015;
2.复旦大学附属中山医院厦门医院中西医结合科,福建 厦门 361015
牙周病是指在牙周组织发生的疾病,是导致牙齿脱落的主要原因,同时也是导致某些疾病的重要因素,如卒中和冠心病等[1]。牙周局部缓释给药系统的优点:避免首过效应、药物贮留时间延长,减少频繁给药、与吸收面直接接触,提高药物的吸收;
维持有效药物浓度。缺点:给药时患者牙周袋意外膨胀[2];
需专门装置给药。原位凝胶即在位凝胶,是一类以溶液状态给药后,能在用药部位立即发生相转变,由液态转化形成非化学交联半固体凝胶的制剂。其相转变的方式有温度敏感[3]、去除溶剂沉淀、酸碱度敏感[4]和离子敏感[5]等多种类型。原位凝胶给药系统同时具备了固体植入剂在局部贮留、缓慢释药和微粒给药系统的可注射性的优势[6]。
盐酸二甲胺四环素(minomycin hydrochloride,MINO·HCl)是治疗牙周病的主要药物[7],其不影响其他组织的新陈代谢。MINO·HCl 有更广的抗菌谱和更强的抗菌活性[8],其对大部分牙周致病菌如牙龈炎杆菌和伴放线杆菌等有明显的抑制作用[9]。MINO·HCl 能降低牙周炎症的宿主反应,促进牙周组织胶原的合成与表达。
在牙周病原位凝胶给药系统中加入透明质酸具有多方面优势。透明质酸作为一种高分子酸性黏多糖[10],有多种重要的生理功能,如调节血管壁的通透性[11],调节蛋白质、水、电解质扩散及运转和促进创伤愈合等。在给药系统中加入透明质酸,可以增大牙周组织细胞膜的通透性,使药物达到更好的吸收率。并且作为高分子聚合物,透明质酸溶于水中能够形成具有一定黏度的胶状物质,可以保护原位凝胶在相转变初期不被龈沟液所带出。同时,在牙周组织的愈合过程中,透明质酸也能起到促进作用[12]。
因此,本研究根据去除溶剂沉淀的原理[13]制备缓释原位凝胶,在牙周袋内注射入缓释原位凝胶,其接触龈沟液后,溶剂扩散并溶于水中,难溶的共聚物沉淀形成凝胶并缓慢释放药物,达到局部治疗牙周病的目的,并且该共聚物可生物降解。
1.1 仪器
JB-1 型搅拌器(上海雷磁新泾仪器仪器有限公司);
AR124CN 电子天平(奥豪斯仪器有限公司);
BA110S 型电子天平(德国赛多利斯公司);
NDJ-8S型数字显示黏度计(上海精密科学仪器有限公司);
KQ-500E 型超声波清洗器(昆山市超声仪器有限公司);
DF-101S 型集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);
JJ-1 型精密增力电动搅拌器(常州国华电器有限公司);
UV-2600 型紫外分光光度计(日本岛津公司)
1.2 试剂
MINO·HCl(上海源叶生物科技有限公司,批号:H25J7B9464);
透明质酸[(hyaluronic acid,HA),上海麦克林生化科技有限公司,批号:P208761];
N- 乙 烯 基 吡 咯 烷 酮[(N-vinyl-2-pyrrolidone,NVP),美国Sigma-Aldrich 公司,批号:122590HH];
N- 甲 基 吡 咯 烷 酮[(N-methyl-2-pyrrolidone,NMP),国药集团化学试剂有限公司,批号:H03556J];
二甲基亚砜[(dimethyl sulfoxide,DMSO),西陇化工股份有限公司,批号:03A19744];
三乙酸甘油酯[(triacetin,GTA),上海源叶生物科技有限公司,批号:117632];
聚乳酸-羟基乙酸共聚物[poly(lacticco-glycolic acid),PLGA50 ∶50,Mw:10000,济南岱罡生物材料有限公司,批号:420892S];
甲基丙烯酸氨烷基酯共聚物E 型(aminoalkyl methacrylate copolymer E,Eudragit®E100,德国罗姆公司,批号:AKS3402);
磷酸盐缓冲液[(phosphate buffer solution,PBS),福州科诺生物有限公司,批号:0039427];
MINO·HCl软膏(新时代药业有限公司,批号:AR0862);
甲醇(分析纯,国药集团化学试剂有限公司,批号:0103611)。
2.1 处方筛选
2.1.1 基质的选择 PLGA50 ∶50 和Eudragit®E100的降解产物对人体无刺激、无毒,具有良好的生物相容性[14],因此选用这二者通过实验进行处方筛选。
2.1.2 有机溶剂的选择 NMP、NVP、DMSO 和GTA均可与水互溶[15],且对人体毒性较低、生物相容性较好,本实验对HA、PLGA50 ∶50、Eudragit®E100 在上述四种溶剂中的溶解度进行了对比实验。分别称取HA、PLGA50 ∶50、Eudragit®E100 三种物质20 mg 于4 个烧杯中,分别加入20 ml 的有机溶剂:NMP、NVP、DMSO 和GTA,放置于室温,观察溶解情况,并记录溶解时间。
2.2 制备工艺
2.2.1 制备的方法 称取HA 和共聚物分别溶于NVP 和NMP 中搅拌溶解,然后称取MINO·HCl 加入其中并搅拌溶解,制成MINO·HCl 缓释原位凝胶。2.2.2 通针性试验 按照“2.2.1”项下的制备方法,MINO·HCl 浓度为10%,用PLGA50 ∶50 和Eudragit®E100 分别制备共聚物浓度为20%和30%的缓释原位凝胶,通过5 ml 注射器(6 号针头)试验两份原位凝胶的通针性。
2.2.3 凝固情况试验 按照“2.2.1”项下的制备方法,MINO·HCl 浓度为10%,用PLGA50 ∶50 和Eudragit®E100 分别制备共聚物浓度为20%和30%的缓释原位凝胶,将其分别注射入PBS 中,观察凝固情况。
2.3 质量评价
2.3.1 观察形态 观察空白原位凝胶和MINO·HCl 缓释原位凝胶的外观形态。
2.3.2 考察通针性 根据处方制备3 批MINO·HCl缓释原位凝胶,通过5 ml 注射器(6 号针头)考察其通针性。
2.3.3 黏度测定 根据处方制备MINO·HCl 缓释原位凝胶,室温条件下使用旋转黏度计(2 号转子,60 rpm)来测定其黏度。
2.4 含量测定
本含量测定方法采用紫外分光光度法进行含量测定。选择适宜的溶剂将原位凝胶中的MINO·HCl 溶解后,通过紫外分光光度计,测定原位凝胶中MINO·HCl 的含量。
2.4.1 波长的选择 精密称取2 mg MINO·HCl于100 ml 棕色容量瓶中,用甲醇溶解,并定容到刻度,得到浓度为20 μg/ml 的MINO·HCl 溶液,用紫外分光光度计在200 ~600 nm 下扫描波长。再取适量的空白原位凝胶(约20 mg)于100 ml 的甲醇中充分溶解,取上清液在200 ~600 nm 下扫描波长。
2.4.2 标准曲线的建立 精密称取25 mg MINO·HCl于25 ml 棕色容量瓶中,用甲醇溶解,并定容至刻度,得到浓度1 mg/ml 的储备液。用甲醇分别稀释成 浓 度 为6、10、14、18、22、26、30 μg/ml 的 溶 液。以甲醇作为对照,在检测波长下测定3 次吸光度,计算平均值。以浓度对吸光度做线性回归方程。
2.4.3 样品含量测定 根据处方制备3 批MINO·HCl 缓释原位凝胶,分别取20 mg 于100 ml棕色容量瓶中,用甲醇溶解并定容至刻度,超声30 min使其充分溶解,再取上清液用上述紫外分光光度法测定3 批缓释原位凝胶中MINO·HCl 的含量。
2.5 体外释放研究
通过对MINO·HCl 缓释原位凝胶和MINO·HCl软膏二者体外释放的比较,对MINO·HCl 缓释原位凝胶的体外释放结果进行评价。
取MINO·HCl 缓释原位凝胶和MINO·HCl 软膏各300 mg 分别加入到含10 ml PBS(0.01 mol/ml,pH 7.4)的西林瓶中,置于恒温加热磁力搅拌器,设定转速为80 rpm,温度为37℃,分别在2、8、24、48、72、96、120、144、168、192、216、240 h 后将西林瓶中液体取出,同时补充37℃的PBS 10 ml。用甲醇分别将取出的溶液稀释至合适的浓度后,以同等稀释倍数的PBS 为对照组,于检测波长下测定其吸光度,通过“2.4.2”得到的方程分别计算二者的浓度和累积释放百分率,以时间对累计释放百分率做药物释放曲线。
3.1 处方筛选
对于有机溶剂的选择,试验结果表明,HA 在NVP 中易溶,在NMP、DMSO 和GTA 中均微溶或难溶,见表1。PLGA50 ∶50、Eudragit®E100 在NMP 和DMSO 中均可以较快溶解,在NVP 中溶解较慢,在GTA 中难以溶解,见表2。DMSO 具有强烈的大蒜的难闻气味,NMP 无难闻气味,安全无毒,生物相容性良好。因此,选用NMP 作为溶剂,NVP 作为助溶剂。
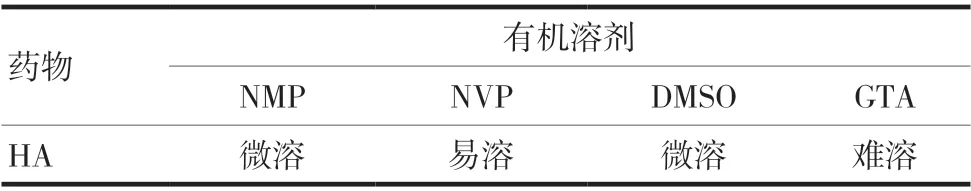
表1 HA在四种有机溶剂中的溶解情况
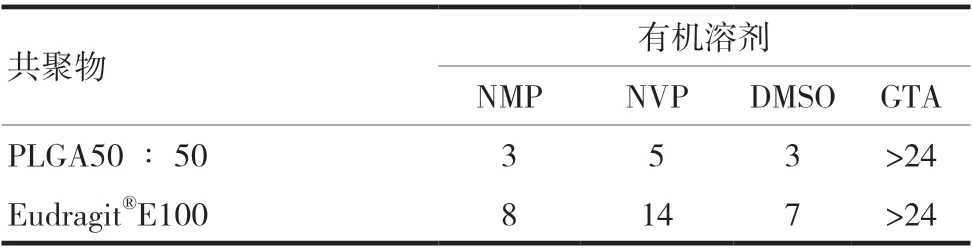
表2 不同共聚物在四种有机溶剂中溶解所需要的时间(h)
3.2 制备工艺
3.2.1 通针性试验 试验结果表明,PLGA50 ∶50和Eudragit®E100 浓 度 为20% 时,其 通 针 性 较好,且相同浓度下Eudragit®E100 的通针性优于PLGA50 ∶50。共聚物的浓度越小,所制成的原位凝胶通针性越好。见表3。

表3 不同原位凝胶的通针性试验结果
3.2.2 凝固情况试验 PLGA50 ∶50 和Eudragit®E100浓 度 为30% 时,其 凝 固 速 度 较 快。
且 用PLGA50 ∶50 制成的原位凝胶比用Eudragit®E100制成的原位凝胶在PBS 中凝固更快,成型性更好,骨架更完整。见表4。因此,选择PLGA50 ∶50 为基质,浓度为30%。

表4 不同原位凝胶在磷酸盐缓冲液中的凝固情况
3.3 质量评价
3.3.1 观察形态 空白原位凝胶为透明黄色液体,色泽均匀,流动性良好。见图1。MINO·HCl 缓释原位凝胶为均匀的棕色透明液体,加入到PBS 中凝固成凝胶状固体。见图2。

图1 空白原位凝胶

图2 MINO·HCl 缓释原位凝胶在磷酸盐缓冲液中凝固
3.3.2 考察通针性 3 批MINO·HCl 缓释原位凝胶,均可以通过5 ml 注射器(6 号针头),其通针性较好。
3.3.3 黏度测定 缓释原位凝胶的黏度为(292.0±5.4)mPa·s,原位凝胶黏度在200 ~300 mPa·s内既可以用于注射,也可以保证其在液体中凝固初期不发生扩散,因此其黏度良好,可用于注射。
3.4 含量测定
3.4.1 波长的选择 MINO·HCl 在波长344 nm处有最大吸收,其他成分在波长344 nm 处不影响对MINO·HCl 的测定,因此波长344 nm 作为MINO·HCl 的测定波长。见图3。
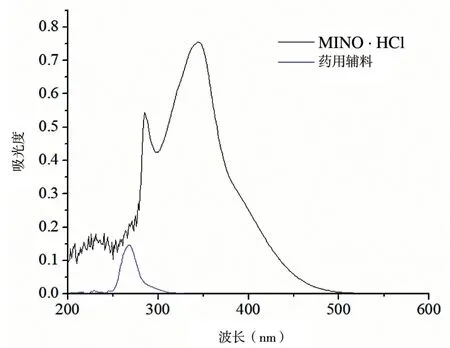
图3 MINO·HCl 和辅料的波长扫描
3.4.2 标准曲线的建立 根据溶液在不同浓度下测得的吸光度,得到线性回归方程:A=0.024C-0.0058,R2=0.9998,MINO·HCl 在6 ~30 μg/ml 范围内线性关系良好,见图4。
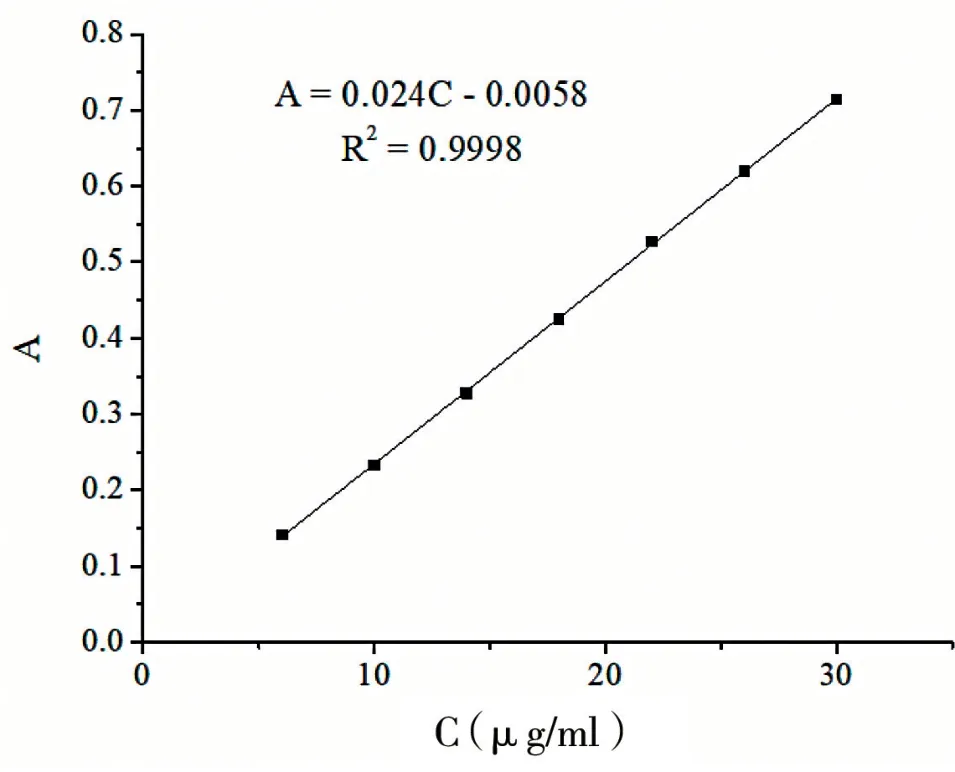
图4 紫外分光光度法测定MINO·HCl 的标准曲线
3.4.3 样品含量测定 测定的3 批样品含量分别 为99.79%、99.21% 和100.86%,含 量 范 围 为(100±1)%,含量均符合要求。
3.5 体外释放研究
原位凝胶在第1 天有37.40%的快速释放,之后便可稳定持续地释放药物,在第7 天累积释放达到90.53%,具有良好的缓释效果;
而MINO·HCl软膏在第1 天累积释放便高达66.97%,在第3 天就达到了91.71%。因此,MINO·HCl 缓释原位凝胶具有良好的缓释作用。见图5。
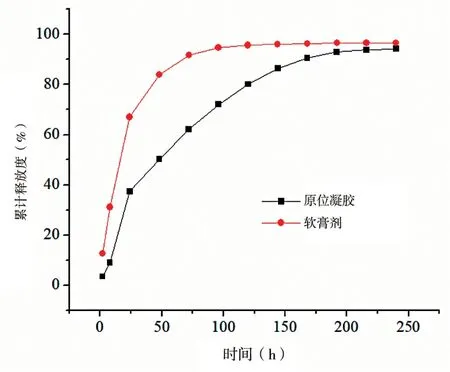
图5 MINO·HCl 缓释原位凝胶和软膏的药物释放曲线
本研究确定了MINO·HCl 缓释原位凝胶的处方成分包括:PLGA50 ∶50、MINO·HCl、HA,NMP、NVP;
制成了一种能够以注射给药的缓释原位凝胶新剂型,其在牙周袋内注入,接触龈沟液后,溶剂扩散并溶于水中,难溶的共聚物沉淀形成凝胶贮留于牙周袋内并缓慢释放药物,达到局部治疗牙周病的目的。后续将进一步研究各处方成分的最适浓度;
研究该原位凝胶的体外释放模型;
考察该原位凝胶制备工艺的稳定性;
以及进一步研究HA的加入所带来的优势。