张 燕 ,蒙卓成 ,邢 欢 ,崔小花 ,杨 柳 ,郑 璇 ,戴尊孝
(1.西安市精神卫生中心,陕西 西安 710100;
2.西安市药学(精神卫生)重点实验室,陕西 西安 710100
精神障碍是一种长期困扰患者的慢性疾病,治疗时需要药物在脑内发挥作用,但因为血脑屏障的存在,药物是难以进入脑内起到疗效的。ABCB1是一种药物转运体[1-2],它在人体大脑的毛细血管中广泛表达[3-4],可以影响p-糖蛋白活性[5],而p-糖蛋白存在于血脑屏障中,在控制血液和大脑之间的物质传递起着重要作用[6],可以改变血组织屏障中挤压回血液中的药物数量[7-11],影响药物浓度[12-14],从而影响药物的疗效。本研究中的ABCB1转运体主要涉及抗精神病药物脑内转运等相关问题。ABCB1转运体的基因突变会影响其转运功能[15-16],使药物无法正常发挥疗效,其中rs2032582是研究最广泛的突变位点[17],通常会存在三等位基因,本研究主要针对rs2032582位点的突变(C.2677T>G),虽然三等位基因存在比例较低,但影响不容忽视。
实时荧光PCR法操作简单、人为误差小,是目前临床上的主流检测方法,对于等位基因的检测结果,实时荧光PCR法可准确判读。但由于ABCB1存在三等位基因,采用实时荧光PCR法会在结果读取方面存在一定困难。多重PCR片段分析可以得到整个序列的直接信息,具有较高的准确度,是直接有效检测基因突变的方法[18],该方法具有测序精度高、测序长度长等特点;
不足之处在于其成本高、通量低、耗时长[19]。故本研究采用多重PCR片段分析法作为对照方法,将实时荧光PCR法的结果读取方法进行明晰,以期实现临床对ABCB1三等位基因准确、简便且低廉的检测。
1.1 样本
收集西安市精神卫生中心2020年3月-2021年3月ABCB1样本2 794例,按照t检验中对样本数量的规定,在理想状态下,样本数多于120,认为其具有正态分布特征,可以代表群体样本。根据120个样本在所收集的样本中占比接近5%,且考虑到实验过程中误差或样本脱落,故按照5%的比例进行抽样,即抽取样本139例,认为此抽样方式能代表样本的分布情形。
1.2 试剂与仪器
Taq Man rs2032582 T试剂盒(赛默飞世尔科技有限公司);
Taq Man rs2032582 A试剂盒(赛默飞世尔科技有限公司);
SNPscanTM分型试剂盒(苏州天昊生物科技有限公司);
HI-DI(美国ABI公司);
Gen⁃eScanTM-500(美国ABI公司)。
StepOne Plus实时荧光PCR分析仪(赛默飞世尔科技有限公司);
FR-110紫外分析装置(上海复日科技有限公司);
凝胶成像仪(上海复日科技有限公司);
FR-250电泳仪(上海复日科技有限公司);
多用途水平电泳槽(北京百晶生物科技有限公司);
BG-Power 300电泳仪(北京百晶生物科技有限公司);
BG-submix cell电泳槽(北京百晶生物科技有限公司);
2720 Thermal CyclerPCR分析仪(美国ABI公司);
Milli-Q Academic超纯水仪(美国Millipore公司);
ABI3730XL测序仪(美国ABI公司)。
1.3 实验方法
1.3.1 实时荧光PCR法
配制 10 μL 反应体系,包括 Master Mix 5 μL,DME assay Mix 0.25 μL,去离子水3.75 μL,DNA样本1 μL[20]。上PCR仪,扩增程序为:60℃、30 s,95℃、10 min,进入扩增循环(95℃、15 s,60℃、1.5 min),循环40次,60℃、30 s,反应结束,输出结果[21-23]。
1.3.2 多重PCR片段分析法
样本扩增:配制10 μL连接反应预混合液,包括10×Ligase Buffer 2 μL,Ligase 0.5 μL,Probe Mix 1 μL,去离子水6.5 μL。进行连接反应,在1 μL DNA样本中加入10 μL连接反应预混合液,轻微震荡混匀,3 000 r/min离心30 s,然后上PCR仪,94℃、1 min,58℃、4 min,循环4次,94℃、2 min,最后降温至72℃结束连接反应。
多重荧光PCR反应[24]:配制20 μL反应体系,包括2×PCR Master Mix 10 μL,Primer Mix Ⅰ or Ⅱ 1 μL,样本扩增溶液1 μL,去离子水8 μL,轻微震荡混匀,3 000 r/min离心30 s,然后上PCR仪,95℃、2 min。第一次PCR反应:94℃、20 s,62℃、40 s,72℃、1.5 min,循环9次。第二次PCR反应:94℃、20 s,57℃、40 s,72℃、1.5 min,循环25次,68℃、60 min,最后降温至4℃结束多重荧光PCR反应[25]。
片段测序:将多重荧光PCR产物稀释10倍后,取1 μL与0.5 μL Liz 500 Size Standard、8.5 μL Hi-Di混匀,95℃、5 min,上测序仪测定。
1.4 统计方法
实时荧光PCR的结果采用StepOne Software v2.2.3进行处理,分别以循环数和荧光强度值的对数作为横纵坐标并绘制扩增曲线,数据分析采用扩增曲线指数增长期对应的Ct值进行对比分析;
多重PCR片段分析的结果采用GeneMapper 6进行处理,数据分析采用碱基峰位图中对应的研究峰位进行对比分析。
2.1 实时荧光PCR法与多重PCR片段分析法读取结果
139例样本中,包括120例等位基因及19例三等位基因。实时荧光PCR法与多重PCR片段分析法对120例等位基因样本的读取结果完全一致。两种方法对19例三等位基因样本的读取结果见表1。

表1 实时荧光PCR法与多重PCR片段分析法对三等位基因分析结果
2.2 三等位基因读取结果的确定
采用实时荧光PCR法测定19例ABCB1三等位基因的结果,以多重PCR片段分析结果作为对照进行解读,将Ct值(PCR扩增进入指数增长期所对应的循环数)作为实时荧光PCR读取依据,重新确定ABCB1三等位基因的分型结果。
2.2.1 T/A/G基因分型读取结果的确定
2.2.1.1 T/A/G基因分型判读为G/G型
图1中,图1a中G碱基与T碱基Ct值分别为21和23,图1b中G碱基与A碱基Ct值分别为21和24,Ct值小的碱基含量高。图1a△Ct.a(∣Ct.G-Ct.T∣)=2,图1b△Ct.b(∣Ct.G-Ct.A∣)=3,两图△Ct值的差值<3(∣△Ct.a-△Ct.b∣=1),故将图1a和图1b中含量高的碱基组合作为判读结果,判读基因型为G/G型。
图1c中,175.78位置的G碱基峰远高于175.01位置的T碱基峰,173.84位置几乎没有A碱基峰,故判读基因型为G/G型。

图1 T/A/G基因分型判读为G/G型两种方法对比图
2.2.1.2 T/A/G基因分型判读为T/G型
图2中,图2a中G碱基与T碱基Ct值分别为23和19,图2b中G碱基与A碱基Ct值分别为21和24,Ct值小的碱基含量高。图2a△Ct.a(∣Ct.G-Ct.T∣)=4,图2b△Ct.b(∣Ct.G-Ct.A∣)=3,两图△Ct值的差值<3(∣△Ct.a-△Ct.b∣=1),故将图2a和图2b中含量高的碱基组合作为判读结果,判读基因型为T/G型。
图2c中,175.78位置的G碱基峰等高于175.01位置的T碱基峰,173.84位置几乎没有A碱基峰,故判读基因型为T/G型。

图2 T/A/G基因分型判读为T/G型两种方法对比图
2.2.1.3 T/A/G基因分型判读为T/A型
图3中,图3a中G碱基与T碱基Ct值分别为25和21,图3b中G碱基与A碱基Ct值分别为27和21,Ct值小的碱基含量高。图3a△Ct.a(∣Ct.G-Ct.T∣)=4,图3b△Ct.b(∣Ct.G-Ct.A∣)=6,两图△Ct值的差值<3(∣△Ct.a-△Ct.b∣=2),故将图3a和图3b中含量高的碱基组合作为判读结果,判读基因型为T/A型。
图3c中,明显存在175.01位置的T碱基峰和173.84位置的A碱基峰,几乎没有175.78位置的G碱基峰,故判读基因型为T/A型。
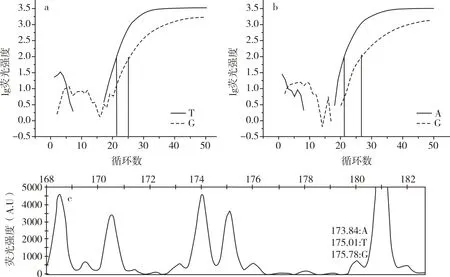
图3 T/A/G基因分型判读为T/A型两种方法对比图
2.2.2 G/T/A基因分型读取结果的确定
2.2.2.1 G/T/A基因分型判读为A/A型
图4中,图4a中G碱基与T碱基Ct值分别为25和22,图4b中G碱基与A碱基Ct值分别为26和20,Ct值小的碱基含量高,但图4a△Ct.a(∣Ct.G-Ct.T∣)=3,图4b△Ct.b(∣Ct.G-Ct.A∣)=6,两图△Ct值的差值=3(∣△Ct.a-△Ct.b∣=3),故此种情况认为Ct值最小的A碱基具有绝对优势。当∣△Ct.a-△Ct.b∣=3,将图4a和图4b中含量最高的碱基纯合型作为判读结果,判读基因型为A/A型。
图4c中,明显存在173.84位置的A碱基峰,几乎没有175.01位置的T碱基峰和175.78位置的G碱基峰,故判读基因型为A/A型。

图4 G/T/A基因分型判读为A/A型两种方法对比图
2.2.2.2 G/T/A基因分型判读为T/A型
图5中,图5a中G碱基与T碱基Ct值分别为22和19,图5b中G碱基与A碱基Ct值分别为24和19,Ct值小的碱基含量高。图5a△Ct.a(∣Ct.G-Ct.T∣)=3,图5b△Ct.b(∣Ct.G-Ct.A∣)=5,两图△Ct值的差值<3(∣△Ct.a-△Ct.b∣=2),故将图5a和图5b中含量高的碱基组合作为判读结果,判读基因型为T/A型。
图5c中,明显存在175.01位置的T碱基峰和173.84位置的A碱基峰,几乎没有175.78位置的G碱基峰,故判读基因型为T/A型。

图5 G/T/A基因分型判读为T/A型两种方法对比图
2.2.3 G/A/T基因分型读取结果的确定
图6中,图6a中G碱基与T碱基Ct值分别为30和19,图6b中G碱基与A碱基Ct值分别为24和21,Ct值小的碱基含量高,但图6a△Ct.a(∣Ct.G-Ct.T∣)=11,图6b△Ct.b(∣Ct.G-Ct.A∣)=3,两图△Ct值的差值>3(∣△Ct.a-△Ct.b∣=8),故此种情况认为 Ct值最小的 T碱基具有绝对优势。当∣△Ct.a-△Ct.b∣≥3,将图6a和图6b中含量最高的碱基纯合型作为判读结果,判读基因型为T/T型。
图6c中,明显存在175.01位置的T碱基峰,几乎没有173.84位置的A碱基峰和175.78位置的G碱基峰,故判读基因型为T/T型。
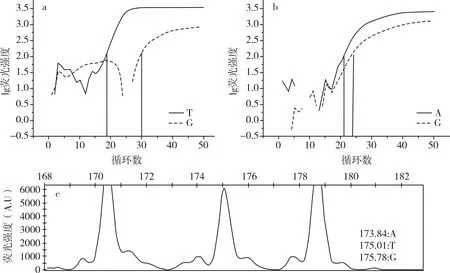
图6 G/A/T基因分型判读为T/T型两种方法对比图
通过对19例ABCB1三等位基因样本进行两种方法判读结果的对比,总结出实时荧光PCR法检测ABCB1基因的读取原则:当∣∣Ct.G-Ct.T∣-∣Ct.GCt.A∣∣<3时,分别读取两组碱基实时荧光PCR扩增曲线图中Ct值最小的碱基,将其组合形成判读结果。当∣∣Ct.G-Ct.T∣-∣Ct.G-Ct.A∣∣≥3,读取两组碱基实时荧光PCR扩增曲线图中Ct值最小的碱基,其纯合型即为判读结果。
根据读取原则,将19例三等位基因的实时荧光PCR法结果重新判读,结果修正为:1例G/G,1例A/A,4例T/G,5例T/A,8例T/T,与多重PCR片段分析法判读结果一致。
在人体中,三等位基因的存在比例相对较低,本研究中的样本比例组成也可体现这一点。但当人体内存在三等位基因且存在的碱基突变比例较高时,突变的碱基在进行基因表达时或许会占优势,人体的相关功能就会受到影响。存在这种高比例的碱基突变时,实时荧光PCR检测方法不能明确判断哪个碱基占优势,所以不便出具基因报告。
在判断何种碱基占优势时,可观察实时荧光PCR扩增曲线的Ct值,Ct值越小,相应碱基的含量所占比例较高。但当存在三等位基因时,一个位点会存在三个碱基,就会有两种不同的扩增曲线图,在判断何种碱基占优势时,就要结合两个扩增曲线图进行对比分析,分析比较两图之间的△Ct值的差值。在扩增曲线图中,当碱基进入指数增长期,每进行一个循环,碱基的量便会翻番,当扩增循环进行3次以后,碱基的量会相差23倍,这时就可以判断何种碱基在表达时占绝对优势。所以,在本研究中,当两者扩增曲线的△Ct值相差3及3以上,均判读为Ct值最小的碱基为纯合子;
当两者扩增曲线的△Ct值相差3以下,分别读取两组实时荧光PCR扩增曲线图中Ct值小的碱基,将其组合形成杂合子。
随着技术不断进步,实时荧光PCR技术与其他分子生物学技术相结合使定量极微量的基因表达成为可能,荧光标记核酸化学技术和寡核苷酸探针杂交技术的发展以及实时荧光PCR技术的应用,使得实时荧光PCR技术有一个足够的基础为广大临床诊断实验室所接受[26-27],未来实时荧光PCR法有望成为进行基因检测研究的主要工具。
猜你喜欢 碱基等位基因分型 肺炎克雷伯菌RAPD基因分型及其与氨基糖苷类药敏分型对比研究中南药学(2022年2期)2022-03-30亲子鉴定中男性个体Amelogenin基因座异常1例智慧健康(2021年17期)2021-07-30CT在早期预测新型冠状病毒肺炎不同临床分型的应用昆明医科大学学报(2021年5期)2021-07-22基因“字母表”扩充后的生命科学之谜(2021年2期)2021-04-25创建新型糖基化酶碱基编辑器科学导报(2020年54期)2020-09-09生命“字母表”迎来新成员学苑创造·B版(2019年5期)2019-06-14生命“字母表”迎来4名新成员科学24小时(2019年5期)2019-06-11用数学思维分析遗传的基本规律新课程·下旬(2018年9期)2018-11-14复杂分型面的分型技巧智能制造(2015年4期)2015-05-12爱笑不爱笑,基因早知道青少年科技博览(中学版)(2015年10期)2015-01-11