陆晨阳,张 婷,任超超,包旦奇,马天馨,牛世奇,李雪松,杨建美,滕巧泱,李泽君,刘芹防
(中国农业科学院上海兽医研究所,上海 200241)
鸭坦布苏病毒(Duck Tembusu virus,DTMUV),属于黄病毒科黄病毒属,遗传物质由单股正链RNA组成。该病毒最早是在中国的东南地区发现并分离到毒株,之后此病毒在南亚地区快速传播[1]。临床上DTMUV感染后的主要症状有高热、食欲下、生长迟缓、产蛋下降,甚至造成鸭只死亡,给我国的养鸭业造成了严重的经济损失[2]。坦布苏病毒与其他黄病毒属病毒,如登革热病毒(Dengue virus, DENV)[3]、日本乙型脑炎病毒(Japanese encephalitis virus, JEV)、寨卡病毒(Zika virus, ZIKV)[4]的传播途径类似,都是以节肢动物为传播媒介,通过叮咬的方式来感染宿主[5]。这些以昆虫为传播媒介的病毒在防控方面存在很大的难度,一方面随着季节变化,温度的上升,导致携带病毒的吸血昆虫大量繁殖[6],导致传播途径无法得到有效的控制。另一方面,自然界中存在大量的潜在宿主或携带宿主,导致传染源也无法得到有效确定并控制[7]。因此目前对于这类疾病的防控主要途径是疫苗免疫[8]。
目前对坦布苏病毒的疫苗研究进展较快,从灭活苗、弱毒苗等基本疫苗再到亚单位疫苗、重组疫苗,各个种类的疫苗均有不同程度的研究进展[9]。灭活苗作为最常用的防治病毒病的常规疫苗,具有安全有效、制造简单、成本低廉等优势,但是也存在着一些方面的不足,例如接种剂量较大,并且对病毒灭活要求较高,免疫周期短,到达保护效价时间长等[10]。相对的弱毒苗在兼具灭活苗的所有优点的前体下能够达到更长的免疫周期,更快的达到保护效价,病毒的扩增也更加方便,是目前预防鸭坦布苏病常用的手段[11]。而亚单位疫苗、重组疫苗目前的研究进展还未能够完全投入临床应用[12]。
疫苗佐剂,一种用于提高疫苗中抗原免疫原性的辅助物质,在疫苗中添加能够增强疫苗免疫原性以达到增强疫苗保护性的做法已被证实非常的高效且安全。随着科学的进步,新的分析方法和工具的问世,大大的加快了免疫佐剂发展的进程。我们现在添加在疫苗中的物质,从无机的化合物到有机化合物,再到现在的生物蛋白质、多肽、甚至是核酸,极大的丰富了疫苗佐剂方面的选择[13]。目前,疫苗佐剂通常使用于亚单位疫苗和灭活疫苗中,而适用于活疫苗的佐剂较少。CpG寡核苷酸(oligodeoxynucleotides containing CpG motifs, CpG ODN)作为一种人工合成寡聚脱氧核苷酸,常被应用于灭活疫苗佐剂,其是否具有增强弱毒活疫苗的免疫效果方面研究较少。本研究将CpG ODN作为免疫佐剂添加至鸭坦布苏弱毒疫苗(FX2010-180P株)中,研究其对弱毒活疫苗的免疫效果的影响。
1.1 细胞和毒种 DF-1细胞由本团队保存,用于病毒滴度的测定。鸭坦布苏病毒病活疫苗(FX2010-180P)由本实验室制备与保存;
DTMUV病毒FX2010原始毒株由本实验室分离与保存。
1.2 主要试剂 DMEM培养基购自hyclone公司;
南美胎牛血清购自PAN公司;
抗TMUV E蛋白单克隆抗体1F5由本实验室制备与保存;
山羊抗鼠IgG-HRP购自Sigma公司;
TMB显色液购自武汉博士德科技有限公司。
1.3 pUC18-CpG Xiao等[14]的研究表明,将20拷贝的CpG ODN 2006(序列为:5"-TCGTCGTTTTGTCG TTTTGTCGTT-3")串联插入至pUC-18的多克隆位点上,所构建的pUC18-CpG质粒按40 μg/只的剂量能够有效提升坦布苏病毒HB株灭活疫苗性能。本次实验所用pUC18-CpG来自北京农林科学院畜牧兽医研究所Shaohua Hou课题组,保存在灭菌PBS中,浓度为2 mg/mL。
1.4 免疫实验 将24只10周龄鸭坦布苏抗体阴性麻鸭随机分成四组,每组6只。第一组接种无佐剂添加的FX2010-180P弱毒疫苗。第二组接种以40 μg/只CpG ODN作为佐剂添加入FX2010-180P中的混合疫苗。接种方式均采用腿部肌肉注射方式。每只鸭按照103.5TCID50剂量接种0.2 mL FX2010-180P弱毒株疫苗。第三组同样以腿部肌肉注射方式接种0.2 mL PBS作为未免疫对照组。第四组不做免疫处理以与3组免疫鸭子同样的饲养方式养殖,作为MOCK对照组。从免疫后第3 d开始,对进行免疫的3组鸭连续7 d采血并分离血清,通过阻断ELISA试验检测不同组合疫苗免疫后鸭只体内的抗体效价变化与转阳率的情况。
1.5 疫苗保护力实验 免疫后18 d,对接种FX2010-180P组、FX2010-180P+CpG ODN组、无免疫对照组进行攻毒,按照103.5TCID50滴度接种FX2010株病毒,肌肉注射接种0.2 mL/只。未进行疫苗免疫的第四组健康鸭以0.2 mL/只的量肌肉接种的灭菌PBS,作为MOCK对照。连续3 d观察各组鸭的感染情况。
1.6 剖检各组鸭子病理变化 攻毒3 d后,将所有4组实验鸭放血剖杀,检查各脏器主要病理变化,取卵巢、脑、脾脏、肾脏、肺脏制作病理切片。
1.7 脏器滴定 滴定前1 d将DF-1细胞以1.0×105个/mL铺至96孔细胞培养板中,37℃、5%CO2细胞培养箱中培养至细胞饱满度在80%左右。各组织脏器分别取1 g,加入1 mL添加10×青霉素链霉素的PBS进行研磨,8000 ×g、4℃离心15 min取上层清澈液体为脏器研磨液。将各组鸭子的各器官脏器研磨液进行10倍倍比稀释至10-6,将不同浓度的各脏器研磨液按浓度加入铺至96孔板中的DF-1细胞中,每孔100 μL,作用2.5 h后将脏器研磨液吸弃,用200 μL灭菌PBS清洗2次后,加入100 μL的细胞维持液,37℃、5%CO2细胞培养箱中培养。培养4 d后,以Reed-Muench法计算病毒的TCID50。
2.1 不同疫苗的转阳率差异 使用阻断ELISA对采集到的免疫鸭血清进行DTMUV抗体检测,根据结果我们发现免疫FX2010-180P的鸭子最早于免疫后3 d即出现了抗体转阳,免疫后第6 d所有的免疫鸭转阳。而添加CpG ODN佐剂组的鸭子则在免疫后5 d出现抗体转阳,在第6 d全部免疫鸭呈现抗体阳性,抗体转阳效率低于未添加免疫佐剂的FX2010-180P组。未免疫组的鸭抗体都是阴性。
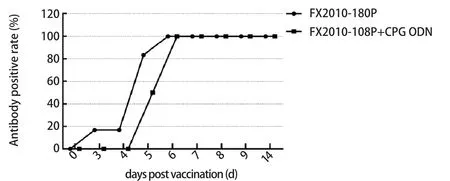
图1 不同免疫组鸭只血清转阳率变化结果Fig.1 Seroconversion rate of immunized ducks at different time points
2.2 不同疫苗阻断率差异 对各组鸭血清抗体阻断ELISA所得数据进行two-ways ANOVA分析,ttest检测,两组免疫不同疫苗鸭子血清中抗体阻断率无明显差异(P>0.05)(图2),不具有统计学意义。

图2 不同免疫组鸭子血清抗体效价水平变化结果Fig.2 Antibody titers of immunized ducks at different time points
2.3 各组攻毒后临床表现 攻毒后24 h观察各组鸭子,发现无免疫组鸭子出现食欲下降、带血稀粪、精神萎靡等症状。阴性对照组与两种免疫组鸭子均未表现出明显的临床症状,精神状况、饮食情况、排便情况均无异常。
2.4 各组鸭脏器病理变化 攻毒后3 d剖检不同免疫组以及空白对照组的鸭子,空白对照组和两个疫苗免疫组鸭只的卵巢、脑、脾脏、肺脏、肾脏外形正常,无典型DTMUV病变;
无免疫对照攻毒组的鸭只均出现脾脏肿大,卵巢出现脓肿卵泡,脑组织粘膜轻微出血充血。
2.5 各组鸭脏器病毒含量滴定 对四个实验组以及对照组各鸭只脏器进行脏器病毒滴度检测,实验结果在未免疫鸭子各脏器中均可以检测到DTMUV,然而两组FX2010-180P株免疫组与添加CpG ODN的免疫组鸭子,在FX2010野毒株感染后,各脏器中均检测不到病毒(图3)。说明两种疫苗免疫后都可以保护鸭子不受野毒株的感染,保护率均达到100%。添加CpG ODN对疫苗免疫效果无明显影响。
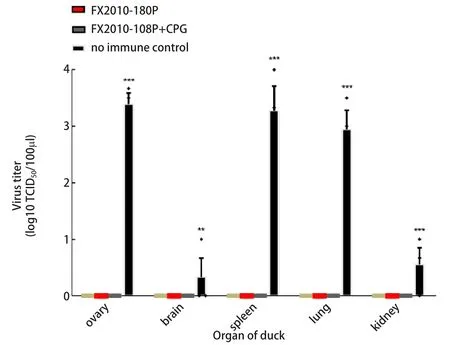
图3 不同免疫佐剂组鸭子脏器病毒滴度Fig.3 Virus titers in different organs of fected ducks
2.6 各组鸭脏器脏器病理切片观察 观察经HE染色制作的不同组鸭子的脾脏、卵巢、肺脏、肾脏切片,阴性对照组鸭子的脾脏可以清晰观察到脾脏的被摸、实质以及形成的小梁结构,脾脏细胞无病变,组织间无出血充血(图4A);
卵巢细胞无病变,组织间无出血充血,卵泡结构完整饱满(图4B);
肺脏肺泡边界清晰,细胞无明显病变,少量噬碱性粒细胞浸润(图4C);
肾脏细胞无明显病变,肾小管、肾小球结构清晰,组织间无出血充血(图4D)。FX2010-180P组和添加CpG组各脏器组织与无感染阴性对照组相似,未见明显组织细胞病变。观察未免疫攻毒组鸭子脾脏被膜结构破坏、细胞松散、不完整,实质组织间有充血出血,嗜酸性粒细胞增多,小梁结构消失(图4M);
卵巢组织出现坏死,卵泡结构不完整有干酪样渗出物(图4N);
肺泡边界消失,组织间有出血充血(图4O);
肾脏嗜酸性粒细胞增多,部分肾小管细胞变性、小管结构破坏,与实质部分细胞间隙不清晰(图4P)。

图4 各实验组鸭子脏器HE染色切片Fig.4 HE staining of sections of different organs of infected ducks
CpG ODN对于免疫系统的主要作用机理是在进入哺乳动物体内后会作为一种病原相关分子模式与细菌DNA所产生的免疫刺激活性相似,主要诱导Th1型免疫应答。其主要作用模式为免疫细胞通过内吞的方式捕获CpG ODN,与模式识别受体TLR-9结合,刺激机体的NF-κB、AP-1、IRF-7转录因子通路,促使细胞表达炎症基因、趋化因子以及抗菌肽,分泌多种细胞因子,通过炎症反应完成对入侵病原微生物的清除[15]。
同时CpG ODN刺激免疫信号通路对于其他各种免疫细胞也有着重要的影响,能够在不依赖T淋巴细胞直接激活B淋巴细胞,上调B细胞表面MHC-Ⅱ类分子的表达,快速活化的B淋巴细胞迅速完成抗原的呈递进而提高抗体的分泌[16]。另一方面通过活化DC细胞,上调MHC-Ⅱ类分子的表达促使其分泌多种细胞因子,IFN-α和TNF-α可以活化T淋巴细胞和NK细胞,进而提高IFN-γ的分泌,诱导Th1型免疫应答[17]。
目前CpG ODN作为免疫佐剂添加在人用乙型肝炎疫苗中的研究已经通过了三期临床阶段,添加进入其他人用疫苗的研究也已经在二期、三期临床实验阶段[15]。作为人用疫苗佐剂具有提升免疫性能明显,与疫苗中抗原物质不发生冲突的提升非特异性的适应性免疫应答的方式,能够有效的提高机体对于病原物质的免疫作用以及抗肿瘤作用,生产成本低,贮存、缓释等方面具有比目前市面上一些常用的佐剂更加优秀。有研究显示,CpG ODN在猪的抗细菌感染方面有着良好的免疫辅助效果[18]。在禽病防治方面,有实验证实了CpG ODN可以增强ALV-J亚单位疫苗的免疫活性[19],但目前大多数兽用疫苗佐剂的应用均还停留在实验室数据阶段,因此具有广泛的市场前景。
本研究结果表明,CpG ODN作为免疫佐剂添加的FX2010-180P弱毒疫苗中与未添加的疫苗相比较都能产生足够的免疫保护能力,使其免受鸭坦布苏病毒的感染。但CpG ODN的添加与否并不影响疫苗的保护性能,两组疫苗在保护性能上并无明显差距。本研究认为疫苗本身是弱毒活疫苗,进入体内后刺激一套完整的免疫应答程序,而CpG ODN的加入在短时间内提高了Th1型细胞免疫,使部分活病毒在还没有被B淋巴细胞识别便被天然免疫或粘膜免疫所杀死,所以并未出现提升抗体分泌水平的现象。
猜你喜欢 佐剂脏器活疫苗 新冠病毒灭活疫苗诞生记小天使·一年级语数英综合(2022年2期)2022-03-30BC02 复合佐剂成分协同增强机体固有免疫应答的分析中国生物制品学杂志(2022年1期)2022-01-19疫苗中的“隐形守护者”知识就是力量(2021年7期)2021-07-28DC-Chol阳离子脂质体佐剂对流感疫苗免疫效果的影响昆明医科大学学报(2021年3期)2021-07-22多脏器功能衰竭到底是怎么一回事?健康必读(上旬刊)(2020年8期)2020-08-13什么是减毒活疫苗保健与生活(2020年10期)2020-05-28在达古雪山巅红岩(2017年6期)2017-11-28Pattern of acute poisoning in Jimma University Specialized Hospital, South West EthiopiaWorld journal of emergency medicine(2016年4期)2016-11-23海湾扇贝外套膜及脏器剥离机理试验江苏农业科学(2015年8期)2015-09-10氢氧化铝佐剂研究进展科技视界(2014年14期)2014-04-17