张玉琴,孙业平,齐建勋
(中国科学院微生物研究所病原微生物与免疫学重点实验室,北京 100101)
从18世纪末英国医生爱德华·詹纳发现接种牛痘可保护人类免受天花病毒感染开始,疫苗学正式诞生。在路易斯·巴斯德等科学家们的推动下,疫苗的概念得到进一步的推广。经过200多年的发展,疫苗接种已成为当今防控传染病最为经济有效的方式之一。迄今为止,疫苗可以预防30多种传染病,是人类医学史上最重要的里程碑[1]。尽管如此,在疫苗研发过程中仍面临挑战:艾滋病、肺结核等疾病仍然严重威胁全人类的生命财产安全;
流感病毒、新型冠状病毒的突变速度之快,严重影响了原有疫苗的保护效果。这再一次使人们认识到,尽快研发出一款对新出现的和可能再次出现的病毒均有效果的通用疫苗是十分重要的。此外,现有的传统疫苗存在缺陷,例如减毒活疫苗虽然保留了较高的免疫原性,但存在逆转为高致病性病原的风险[2]。灭活疫苗在制作过程中往往需要加入抗原以外的复杂成分,存在引发未知风险的可能性,且在灭活过程中疫苗会丧失大部分抗原表位,只能诱导机体产生较弱的免疫反应,通常需要多次给药或使用佐剂辅助。抗体依赖性增强(antibody dependent enhancement ,ADE)也是减毒活疫苗和灭活疫苗需要解决的另一个问题[3]。亚单位疫苗在近几年的研究中获得较多的关注。亚单位疫苗通过体外蛋白纯化获得病毒抗原,与其他疫苗相比,它不含任何遗传物质,因此具有更高的安全性;
但亚单位疫苗的缺点是免疫原性差,需要佐剂辅助和重复接种。纳米技术的出现弥补了亚单位疫苗的不足。基于纳米颗粒所研发的纳米颗粒疫苗不仅保持了亚单位疫苗的安全性,还提高了免疫原性和稳定性,这就解决了传统疫苗的大部分局限性,因此纳米颗粒疫苗被认为是极具潜力的疫苗研发平台。
纳米颗粒疫苗主要通过3种方法递呈所携带的抗原(见图1),分别是共价结合、吸附(在纳米颗粒表面)和包封(在纳米颗粒内)。纳米颗粒疫苗的优势主要在于其尺寸,其纳米级的大小可匹配大多数感染性病毒,因此无需佐剂,其免疫原性就接近天然病毒。同时在给药时,纳米颗粒疫苗可轻易穿透毛细血管和黏膜细胞表面,这使疫苗的给药方式不再局限于注射,还可以通过鼻腔给药,这可有效激活黏膜免疫,大大提高了免疫效率。除尺寸大小外,随着化学技术和生物工程的进步,纳米颗粒的形状、溶解度、表面性质和亲水性等均可调节和控制,从而制备具有特定生物特性的纳米颗粒,最终达到增强抗原递呈和获得强大的免疫原性的目的。研究表明,纳米颗粒可起到暂时的抗原存储作用,一方面可防止抗原在诱导机体产生免疫反应之前被蛋白酶降解,另一方面可确保将抗原持续地递呈给免疫细胞。最重要的是,携带抗原的纳米颗粒疫苗可调节个体的免疫反应以获得理想的效果,这是纳米颗粒疫苗研发的基础[4],也是所有疫苗研发的最终目的。目前,超过26种候选纳米颗粒疫苗已进入临床试验阶段,另有60种处于临床前开发阶段[5]。本文重点介绍纳米颗粒疫苗的优势,比较全面地总结目前应用较多的纳米颗粒疫苗研发载体,旨在为新型抗病毒疫苗的研发提供参考。
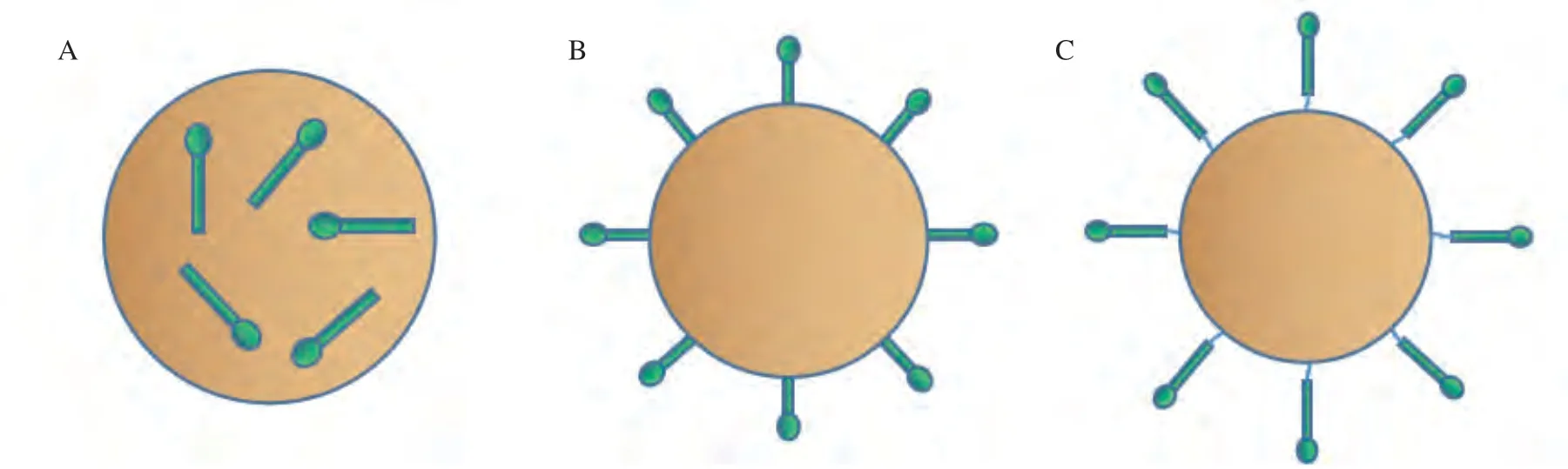
图1 纳米颗粒疫苗递呈病毒抗原的3种方法Figure 1 Three ways to present viral antigens in nanoparticle vaccines
传统疫苗通常采用的给药方式为肌肉或皮下注射,因为能够诱导血清免疫球蛋白G(IgG)的产生。然而对于呼吸道病毒感染来说,最好的给药方式是鼻腔或肺部黏膜给药,这是由于呼吸道病毒或细菌是通过肺黏膜感染人类。黏膜免疫系统是人体内免疫系统的第一道防线,是人体免疫网络的重要组成部分,在抗击感染方面发挥重要作用,因此有效激活黏膜免疫,诱导分泌型免疫球蛋白A(sIgA)的产生是对抗呼吸道病毒的最佳方法。然而黏膜给药要求疫苗不含任何可能会在给药部位引起炎症反应的佐剂,传统疫苗通常无法满足这一要求。纳米颗粒疫苗由于大小接近天然病毒,免疫原性较高,无需佐剂就能刺激机体产生免疫反应,且纳米级颗粒可轻易穿透毛细血管和黏膜细胞表面(见图2A),因此是作为黏膜给药的首选疫苗。Kurosaki等[6]将纳米颗粒疫苗经肺给药成功诱导小鼠产生黏膜免疫。Zhao等[7]的研究也证明,通过鼻腔给药的壳聚糖纳米颗粒能够增强鸡的黏膜免疫应答。
疫苗接种的主要目的是激活个体或群体免疫系统的先天免疫和适应性免疫反应,以获得长期的保护性免疫[8],因此是否能够诱导体液免疫和细胞免疫反应的产生是疫苗开发的一个关键参考因素。与其他疫苗相比,纳米颗粒疫苗在刺激机体产生免疫应答方面具有许多理论优势,包括增强抗原递呈细胞(antigen presenting cell,APC)对纳米颗粒的捕获、通过受体交联激活抗原特异性B细胞的活化,以及通过淋巴循环将抗原定位在滤泡树突状细胞(follicular dendritic cell,FDC)处,促进抗原递呈。
2.1 增强抗原递呈细胞对纳米颗粒的捕获
病原体进入人体内首先被巨噬细胞(macrophage,Mφ)等APC捕获,之后APC将病原体样本递呈给T细胞,并携带病原体样本至淋巴结,被B细胞识别,最终激活机体免疫应答,清除病原体。树突状细胞(dendritic cells,DC)作为重要的APC在这个过程中发挥着核心作用,因此DC是疫苗接种的主要靶细胞。纳米颗粒疫苗通过影响DC在抗原递呈中的功能,来影响适应性免疫反应,这主要得益于纳米技术的进步。通过纳米技术可将纳米颗粒改造成需要的尺寸、形状、表面特性等,而这些特性会影响DC对纳米颗粒的摄取程度,最终达到免疫调节的目的[9]。尺寸约为100 nm的纳米颗粒非常有利于DC的摄取。这是由于大小在100 nm左右的纳米颗粒可以自由流入淋巴结,并暴露给在此常驻的DC[10]。此外,纳米颗粒的表面电荷和形状也会影响DC对纳米颗粒的摄取。由于细胞膜的阴离子特性,带正电的纳米颗粒更易被DC摄取。相对于棒状或其他形状的纳米颗粒,球形的纳米颗粒更易被DC摄取[11]。此外,也可以在纳米颗粒疫苗的制作过程中加入模式识别受体(pattern recognition receptor,PRR)激动剂,如Toll样受体(Toll-like receptors,TLR)等,诱导APC的成熟。研究表明,在纳米颗粒疫苗配方中添加PRR激动剂可显著增强机体的免疫应答和疫苗的效力[12]。
2.2 刺激B细胞的活化,增强体液免疫
纳米颗粒疫苗主要是通过模拟天然病毒入侵机体的形式来启动免疫反应,将免疫原密集地排列在纳米颗粒表面通常能有效地提高其免疫原性,但抗原的表面排列密度很重要。有研究表明,在纳米颗粒表面展示人类免疫缺陷病毒(human immunodeficiency virus,HIV)的包膜糖蛋白(envelope,Env)三聚体,能够诱导产生较天然Env三聚体更有效的中和抗体反应。同时,当单个B细胞受体(B cell receptor,BCR)能够识别2个表面抗原时,抗原与受体之间的结合亲和力最高[13]。小鼠实验也证明,纳米颗粒表面抗原的密度与小鼠对呼吸道合胞病毒(respiratory syncytial virus,RSV)免疫原的中和反应强度相关[14]。纳米颗粒疫苗还可同时将多个抗原递呈给单个B细胞。有研究发现,在单个纳米颗粒上近距离展示多种菌株的流感血凝素(hemagglutinin,HA)蛋白有利于B细胞的扩增,B细胞通过识别不同菌株之间保守的抗原表位,产生对不同菌株均有预防效果的中和抗体[15],这也为流感通用疫苗的研发提供了新的思路。
抗原的重复排列是病原体表面的一种自然特征,它比随机聚集的抗原更能刺激B细胞反应。这说明对称性也是刺激B细胞产生抗体的一个重要因素。Kanekiyo等[15]的研究显示,在纳米颗粒上以八面体对称排列流感病毒血凝素抗原,证实了病毒的几何特征在刺激细胞产生免疫应答方面发挥着重要作用。此外,纳米颗粒还可增强其表面抗原的稳定性,维持其所需的天然构象。
2.3 改变抗原在淋巴结内的迁移和定位,促进抗原递呈
APC在识别和捕获抗原后,可迁移至局部淋巴结,其迁移的部位不同,对之后的免疫反应产生的影响也不同。对于体液免疫而言,抗原主要定位在滤泡和生发中心(germinal center,GC),这是由于体液免疫所需要的B细胞需要在此增殖和突变。FDC在生发中心中发挥着重要作用,它将特定抗原持续性递呈给B细胞。因此,将抗原定位于淋巴结的FDC处是有效启动体液免疫的重要步骤。科学家们在研究可溶性和颗粒性HIV-Env免疫原的淋巴结定位时发现,以纳米颗粒形式展现的Env三聚体免疫原会改变其在淋巴结内的迁移和定位。可溶性HIV gp120或gp140三聚体抗原主要定位于滤泡间区域,集中在表达SIGN-R1(识别病毒的多种突变,指导机体的免疫反应,消除病毒)的巨噬细胞上。然而纳米颗粒形式的gp120或Env三聚体在免疫后几天内主要集中在FDC上,并与新生的GC共定位[16]。此外,纳米颗粒的大小也会影响其定位。直径小于15 nm的纳米颗粒在免疫后可迅速进入淋巴结滤泡间区,但48 h后就会被清除。相比之下,直径为50 ~ 100 nm的纳米颗粒在免疫后12 h内进入滤泡,但可在此处持续数周。组织学染色也证实这些纳米颗粒在后期可以与FDC和GC共定位[17]。这表明在未来的疫苗研发过程中,可以考虑通过构建纳米颗粒的形式来促进抗原向FDC的迁移。
在向人体内输送抗原或药物的过程中,由于其自身溶解度、吸收率、靶向性以及易降解等特性的限制,抗原或药物通常很难高效率地到达需要其发挥作用的地方,尤其是病毒核酸。与蛋白质不同,核酸高度不稳定,在体内易被核酸酶降解。例如mRNA是一种带负电荷的大分子,不能通过细胞膜扩散,但它必须进入细胞内才能被翻译为蛋白质,从而发挥疫苗的防御效果。纳米颗粒技术的发展在一定程度上改善了这些问题,这主要得益于纳米颗粒的稳定性以及其制备的多样性,尤其是通过调节纳米颗粒的电荷属性来帮助疫苗和药物内体逃逸。
纳米颗粒在进入人体后,通过细胞胞吞作用进入细胞。被包裹在内体中的纳米颗粒面临着2种命运,一种是通过胞吐作用被排出细胞,另一种是囊泡被溶酶体中的酶降解,纳米颗粒进入细胞。为了发挥疫苗的作用,必须要通过溶酶体途径将纳米颗粒转移至细胞质中。提示,纳米颗粒内体逃逸的重要性[18]。带正电的纳米颗粒可以通过静电相互作用与带负电的mRNA形成复合体,包裹mRNA,保护mRNA不被核酸酶降解。此外,阳离子纳米颗粒在破坏内体膜的稳定性方面发挥重要作用。在低PH值的内体内,带正电的纳米颗粒可以通过诱导非双层脂质结构的形成来破坏内体膜,从而使药物或抗原进入到细胞质中(见图2B)。

图2 纳米颗粒疫苗穿透黏膜细胞及内体逃逸Figure 2 Nanoparticle vaccines penetrate mucosal cells and escape from endosomes
4.1 脂质纳米颗粒
脂质纳米颗粒(lipid nanoparticle,LNP)是由磷脂、胆固醇和其他分子组成的单层或多层的球形囊泡,LNP可被用于在表面呈现病毒抗原或在内部包裹病毒抗原。通过改变LNP合成过程中使用的每种脂质的类型和比例,可以调整LNP的性质以满足不同的要求[19]。LNP通常直径为80 ~ 200 nm,这与大部分病毒大小一致,因此其自身就具有强大的免疫原性,无需额外的佐剂[20]。通过微流控设备也能够快速有效地混合LNP成分,以生成尺寸可控的LNP。LNP在低pH值下带正电,可以包裹带负电的mRNA,这在协助纳米颗粒内体逃逸方面发挥重要作用。LNP的优点在于可以在体外合成和制造,而不需要活细胞的参与。LNP已被广泛应用于mRNA-LNP疫苗的制作,有些mRNA-LNP疫苗已进入临床阶段。例如,由新型冠状病毒(SARS-CoV-2)的S蛋 白mRNA与LNP共 同 制 成 的BNT162b2 mRNA-LNP疫苗的研究发现,与未接种该疫苗的受试者相比,接种2针剂该疫苗可保护受试者免受SARS-CoV-2(Wuhan-Hu-1株)的感染,其有效率可超过90%,且发生严重不良反应的概率较低[21]。同样的研究结果在以色列的研究中也被观察到[21]。在美国,mRNA-LNP疫苗可保护超过94%的65岁以上的老人避免因2019新型冠状病毒病(COVID-19)相关疾病而住院[22]。Ⅰ期临床试验显示,经mRNALNP疫苗免疫后的中和抗体反应持久,在所有健康成人参与者体内可存在6个月[23]。通过LNP在表面展示HIV包膜蛋白Env制成的HIV纳米颗粒疫苗也被证明有良好的效果。研究发现,HIV脂质体纳米颗粒疫苗在B细胞活化方面优于可溶性Env三聚体。当给恒河猴注射脂质体纳米颗粒疫苗后,生发期卵泡辅助性T细胞和生发中心增殖性B细胞的数量明显增加,这在可溶性Env三聚体未见[3]。此外,与可溶性Env三聚体相比,Env-LNP疫苗诱导机体产生中和抗体(neutralizing antibody,NAb)的反应较可溶性Env三聚体要高[24]。然而,LNP疫苗仍存在一些缺点,例如通过非共价连接抗原时,该疫苗在体内不稳定,无法有效保留其表面的抗原蛋白。抗原偶联效率、大小、颗粒完整性和均一性仍是需要解决的问题(见表1)。此外,mRNA-LNP疫苗需要冷链储存(< -20℃),这限制了其在基础设施不发达地区的部署。
4.2 有机聚合物纳米颗粒
有机聚合物纳米颗粒是由有机单体单元构成的大分子固体颗粒。与无机纳米颗粒相比,有机聚合物纳米颗粒具有更高的免疫原性、更好的靶向性和可降解性,因此在疫苗的开发中具有特别重要的意义。由于有机聚合物纳米颗粒具有优异的生物相容性和较大的比表面积,可轻松地将病毒抗原装入其核心或吸附在其表面,从而实现诱导机体产生高强度的免疫反应的目的[25],因此有机聚合物很早就被广泛应用于纳米颗粒疫苗的制备。根据来源不同,有机聚合物可分为天然聚合物、半合成聚合物及合成聚合物,它们各有优势。例如,天然聚合物纳米材料具有比合成聚合物纳米材料更好的生物相容性,因为前者是在自然界中天然存在的,例如,壳聚糖、海藻酸钠和纤维素等。然而合成聚合物纳米颗粒具有可定制的化学、生物特性,比天然聚合物纳米颗粒更能满足需求,例如聚乳酸-乙醇酸[poly(lactic-co-glycolic acid),PLGA]、聚乳酸(polylactic acid,PLA)、聚乙醇酸(polyglycolic acid,PGA)和聚乙二醇(polyethylene glycol ,PEG)等。
壳聚糖是一种天然阳离子多糖,通过静电相互作用与质粒DNA或其他带负电的蛋白质结合。同时,带正电的壳聚糖可以与带负电的唾液酸产生静电相互作用,促进鼻腔给药后纳米颗粒在气道上皮细胞表面的黏附。壳聚糖纳米颗粒的表面可用甘露糖修饰。甘露糖的先天免疫识别可能有助于更多的纳米颗粒穿梭于FDC网络,并迁移至淋巴结的生发中心[16]。Zhang等[26]研究了壳聚糖纳米颗粒疫苗的抗RSV感染的效果。该研究采用壳聚糖纳米颗粒携带靶向NS1基因的小干扰RNA(small interfering RNA,siRNA)制成RSV纳米颗粒疫苗,通过鼻内给药,注射到被RSV感染的小鼠体内。结果显示,在注射疫苗后,小鼠体内RSV复制明显减少,Ⅰ型干扰素含量升高,CD4+T细胞向辅助性T细胞Ⅰ型分化,这表明壳聚糖纳米颗粒可保护小鼠抵御RSV感染。PLGA是一种高度可生物降解的合成聚合物,可在体内水解成无毒的乙醇酸盐和乳酸,安全地被排出体外。此外,PLGA还可被定制成各种所需要的大小和形状,控制抗原释放速率。因此,PLGA纳米颗粒也被用于抗病毒纳米颗粒疫苗的研发。Dhakal等[27]已研发出包裹灭活猪流感病毒H1N2抗原KAg的PLGA纳米颗粒疫苗,并在猪模型中评估了其免疫原性。结果发现,经鼻接种PLGA-KAg疫苗的猪表现出免疫细胞增殖增强的现象,与存在发热的对照组猪相比,接种PLGA-KAg疫苗的猪未表现出临床流感症状。Galloway等[28]的研究还证明,与单独的可溶性抗原制成的疫苗相比,装载流感病毒抗原的PLGA纳米颗粒疫苗更安全,同时诱导机体产生更高的免疫反应。总之,有机聚合物纳米颗粒因其生物相容性、有效的黏附性和生物可降解性及可修饰的物理化学性质(见表1),成为疫苗研发的有力平台。然而由于此类疫苗研究主要集中在流感病毒上,对其他呼吸道病毒如SARS-CoV-2、RSV等病毒的研究有限,因此还需进一步研究。
4.3 病毒样颗粒
病毒样颗粒(virus-like particle,VLP)通常是由病毒结构蛋白自组装形成的非复制性结构。病毒结构蛋白,如包膜糖蛋白和衣壳蛋白,均可在体外细胞培养中共表达并自组装成颗粒形态的VLP。VLP可以由重复的病毒抗原单体自组装形成,也可以由几种病毒结构蛋白自组装形成,由于不含病毒遗传物质,VLP疫苗在保留了重组亚单位疫苗的优势的同时,还消除了减毒疫苗可能发生感染的风险。VLP可以在细菌、哺乳动物细胞系、昆虫细胞系、酵母和植物细胞中产生。与哺乳动物细胞表达的VLP疫苗相比,重组杆状病毒衍生结构产生的VLP表现出更高和更广泛的免疫反应。VLP的形态特征与大小模拟了天然病毒的特征,其表面有病毒抗原的重复结构和自然保留的抗原构象,这使得VLP具有较高的免疫原性(见表1),可诱导机体产生先天性和适应性免疫反应。葛兰素史克(Glaxo Smith Kline)公司开发的首款乙型肝炎病毒VLP疫苗于1986年商业化。随后,其他VLP疫苗也被相继开发并商业化,例如葛兰素史克公司的人乳头瘤病毒疫苗Cervarix、默克(Merck & Co. Inc)公司的乙型肝炎病毒疫苗Recombivax HB和人乳头瘤病毒疫苗Gardasil。此外,流感病毒的VLP疫苗也在研发中。研究显示,H1N1或H3N2流感病毒的VLP疫苗可针对同源和异源流感病毒抗原产生保护效果[29],在小鼠和雪貂模型中流感病毒VLP疫苗针对同源和异源病毒能够产生有效的血凝抑制(hemagglutination inhibition,HI)滴度。Geng等[30]研发了一种针对SARS-CoV-2的VLP疫苗,在颗粒表面显示120个单位的抗原表位即受体结合结构域(receptor binding domain,RBD),与普通RBD疫苗相比,VLPRBD疫苗在小鼠体内诱导产生的中和抗体是普通RBD疫苗的5倍,且这些中和免疫反应可持续2个月。这些结果表明,VLP疫苗也是有潜力的疫苗研发平台,但目前针对VLP疫苗的结果均是在小鼠模型中得到,在人类体内是否会产生同样的效果尚未知,因此还需要进一步的研究。
4.4 自组装蛋白
自然界中有许多天然存在的可自组装成纳米颗粒的蛋白质,其所含有的自组装基序使可溶性蛋白自组装成蛋白质纳米颗粒。自组装蛋白通常由多个重复的亚单位结构组成,形状不一,如笼状、管状、线状和环状等,由于其独特的结构特征、对称性和相对易于修饰的特点,它们可以很容易地与蛋白质、肽和合成分子等相融合,因此此类蛋白质已被广泛应用于生物分子工程和生物医学领域[31]。自主装蛋白最大的特点是可以在表面同时展示不同种类的抗原表位(见表1),因此其可被用于制备抵御多种病毒感染的多价疫苗。铁蛋白(ferritin)是细胞内具有储存铁功能的蛋白质,在许多组织中均有表达。铁蛋白能够自组装成具有对称结构和有序矩阵的球状纳米笼。铁蛋白纳米颗粒自排列为八面体,由8个三聚体单元组成,允许三聚体抗原在纳米颗粒表面以天然构象呈现。由于铁蛋白具有耐热和耐化学应力的特点,其被广泛应用于疫苗研发。在HIV疫苗的研发过程中,He等[32]和Sliepen等[33]的研究均表明,与普通Env三聚体疫苗相比,装载Env三聚体的铁蛋白纳米颗粒疫苗能够在家兔体内诱导产生更多的中和抗体。Joyce等[34]利用铁蛋白研发的SARS-CoV-2纳米颗粒疫苗也被证明能够产生较强的中和抗体滴度。此外,其他自组装蛋白如热休克蛋白(heat shock protein,HSP)、E2蛋白等,也是纳米颗粒疫苗研发的有效载体。
除天然存在的自组装蛋白外,基于计算设计产生的体外自组装蛋白也在疫苗研发过程中得到广泛应用。体外组装的纳米颗粒可以更好地控制抗原蛋白的质量,因为在组装之前可以对抗原蛋白进行纯化[35]。目前应用较多的体外组装纳米颗粒有通过SpyCatcher和SpyTagged共价偶联的蛋白质,以及I53-50纳米颗粒。尤其是后者,有研究证明SARSCoV-2和RSV的I53-50纳米颗粒疫苗能有效诱导中和抗体产生[36]。对家兔模型的免疫研究表明,通过I53-50展示HIV包膜蛋白的纳米颗粒(Env-I53-50NPs)的免疫原性与普通Env相比显著增强。此外,Env-I53-50NPs在促进机体产生中和抗体方面优于Env铁蛋白纳米颗粒[35]。因此可以推测,体外组装的纳米颗粒将对下一代疫苗产生越来越大的影响。无论是体内组装还是体外组装的纳米颗粒,均可能刺激免疫系统产生针对其自身的抗体反应。铁蛋白纳米颗粒疫苗和I53-50纳米颗粒疫苗均能够引发机体产生针对其自身的中和抗体的反应[37],这不会影响其针对RSV和流感病毒的中和抗体反应,但可能会干扰抗HIV-1的中和抗体反应[38]。
肽自组装是一个涉及化学、生命科学和材料科学的跨学科研究领域。肽可以通过计算从头设计,也可以从天然蛋白质序列中提取,是制备纳米结构的一类重要分子构件[39]。由于肽本身在生物合成过程中和生物合成后易于修饰的特点,肽也被用来研发纳米颗粒疫苗。自组装肽水凝胶作为一种可注射的多功能支架材料在药物释放和组织再生方面显示出巨大的发展前景[40]。人工合成的β-折叠自组装肽能够起到稳定抗原并增强免疫反应的作用。研究人员合成了一种自组装的嵌合肽,该嵌合肽为十聚体,每个单体包含一个β-折叠序列和甲型流感病毒的高度保守表位M2e,最终形成一个100~200 nm的均匀纳米棒(nanorods,NR),M2e表位位于其表面。结果显示,M2e-NRs被抗原递呈细胞有效摄取,在小鼠体内显示出强烈的M2e特异性IgG反应[40]。
4.5 无机纳米颗粒
目前有许多无机纳米颗粒被应用于生物医学。然而,由于颗粒聚集的特性,普通无机纳米颗粒本身不适合用于生物流体。因此,在医疗领域,这些纳米颗粒通常通过吸附或化学反应被有机分子包裹,故称其为具有无机核和有机外壳的混合纳米颗粒。在无机纳米颗粒中,最常用于疫苗接种的是金纳米颗粒(Au nanoparticle,AuNP)。AuNP很容易被Mφ和DC内化,并诱导抗原递呈细胞的激活。包括佐剂和抗原等多种分子,均可以高密度结合在AuNP上,从而提高纳米颗粒的免疫原性和抗原递呈效率。AuNP可经鼻内给药,扩散至淋巴结,触发强烈的抗原特异性细胞毒性T细胞免疫反应[41]。尽管AuNP构成了一个有吸引力的疫苗研发平台,但它们可在肝和脾等器官中长期积累,可能具有毒性。用生物相容性材料涂层可降低其毒性,但这可能会导致纳米颗粒物理化学和生物特性的改变。因此,AuNP的安全问题仍然需要解决(见表1)。除AuNP外,银纳米颗粒(Ag nanoparticle,AgNP)也被用于疫苗的研发。Pilaquinga等[42]的研究表明,AgNP在治疗SARS-Cov-2方面有效,且在通过吸入给药时副作用最小。
4.6 噬菌体蛋白质外壳
噬菌体是一类可感染细菌但不感染人类的病毒。每种噬菌体均有自己独特的大小和形状,但通常呈对称结构,因此其可被开发用作某些病毒疫苗的载体,预防多种传染病。P22噬菌体由一个60 nm的二十面体衣壳和一个尾部区域组成。研究人员利用P22噬菌体开发了一种流感病毒PR8特异性疫苗,将血凝素蛋白的球状头部结构域通过连接酶连接到P22噬菌体外壳上,将该疫苗对小鼠进行免疫,然后用PR8甲型流感病毒对小鼠进行攻击,最终接种疫苗的小鼠存活率为100%,而未接种的小鼠存活率为50%。此外,与对照组相比,该疫苗诱导产生的抗原特异性IgG抗体水平提高了一倍[43]。Qβ是一种具有二十面体外壳的噬菌体,长约25 nm。Qβ已被用作传染病和癌症的疫苗支架[44],如流感、疟疾等。在最近的一项研究中,研究人员通过基因工程和化学结合的方法,开发了几种在Qβ外壳上展示HIV-1抗原的方法。经过为期6个月的家兔实验后,该研究发现在Qβ外壳上展示全长HIV-1抗原,可产生更高的中和抗体滴度[45]。噬菌体T4目前也被用于应对SARS-CoV-2,其为核酸疫苗提供载体,保护病毒核酸不被降解,并模拟天然病毒入侵机制确保核酸的有效递送,但也存在病毒载体本身可能引发机体产生免疫反应的缺点(见表1)。
4.7 去溶剂化纳米颗粒
蛋白质溶液中物理化学条件的变化可以驱动蛋白质纳米颗粒的形成。脱溶剂化形成的纳米颗粒的尺寸为50~300 nm。由于物理化学条件的变化是动态过程,因此以这种方式组装的纳米颗粒通常大小不均匀,但可显示出正态分布的大小范围。通过乙醇去溶剂化可将流感病毒抗原M2e或流感病毒HA自组装成蛋白质纳米颗粒。由于这些去溶剂化纳米颗粒完全是由抗原成分组装的,且为完全可溶的结构,因此在所有蛋白质纳米颗粒中,这种纳米颗粒的抗原载量最高(见表1)。去溶剂化纳米颗粒的另一个优点是,可与不同的抗原蛋白质一起经历多个颗粒组装过程周期。由于不同的抗原蛋白质稳定性不同及理化性质差异,脱溶剂化可使它们在纳米颗粒核心外形成不同的片层,产生多层纳米颗粒,从而将抗原蛋白组装到颗粒周围的不同片层中。研究人员已利用乙醇将流感病毒抗原M2e脱溶剂化形成的纳米颗粒作为核心,并在外层通过化学交联连接结构稳定的流感病毒HA柄,制备了双层蛋白质纳米颗粒。这种分层的蛋白质纳米颗粒可以最大限度地发挥不同抗原的不同免疫作用。小鼠皮肤免疫实验表明,这种蛋白质纳米颗粒疫苗可以对各种流感病毒产生普遍免疫,且免疫效果能维持4个月[46]。

表1 各类纳米颗粒疫苗优缺点比较Table 1 Comparison of advantages and disadvantages of various nanoparticle vaccines
自2019年COVID-19疫情暴发至今,有各类针对SARS-CoV-2的纳米颗粒疫苗正在研发过程中,如mRNA-LNP疫苗、病毒样颗粒疫苗和自组装纳米颗粒疫苗等。有部分疫苗已进入临床阶段并取得优异的结果。除前文已述的BNT162b2 mRNA-LNP疫 苗 外,Baden等[20]研 发 的mRNA-1273新 冠 病毒疫苗,也是一种LNP疫苗。该试验共招募了30420名志愿者,以1∶1的比例随机分配,分别注射疫苗或安慰剂。最终结果证明,该疫苗预防SARSCoV-2的有效率达到94.1%,且暂未发现任何安全问题。Keech等[47]研发的NVX-CoV2373是一种由SARS-CoV-2的三聚体全长S蛋白与Matrix-M1佐剂共同组成的纳米颗粒疫苗。临床试验结果显示,该疫苗的安全性良好,注射该疫苗后大部分受试者无明显不良反应或只表现出轻微不良反应;
该疫苗有效性良好,在注射2针剂5 μg该疫苗后,受试者体内均产生有效的免疫反应。
尽管病原体各不相同,但传染性病毒均有共同的特点:已知病毒重新出现的不可预测性,以及未知病毒导致新疾病出现的不可预测性、高发病率和深刻的社会经济影响,这也强调了研发通用疫苗的重要性。纳米技术的发展为尽早解决这一问题提供了新的思路。纳米颗粒疫苗因其具有与天然病毒类似的结构、安全性好、免疫原性良好、结构稳定以及独特的显示外源蛋白的能力,被广泛应用于生物医学领域中[48]。基于纳米颗粒的疫苗可刺激机体产生针对病毒的更强大的保护性抗体,因此纳米颗粒疫苗是一种强大而灵活的疫苗研发平台。然而,尽管纳米颗粒疫苗已展示出巨大的发展前景,仍有一些缺点不可忽视。首先关于纳米颗粒疫苗的设计尚未探索到最有效的设计方案,其靶向、生物分布和代谢清除等还需进一步研究。其次,实现纳米颗粒疫苗大规模的生产及可持续、可重复性的问题仍待解决。再次,目前世界上针对病毒的疫苗的部署仍存在不公平的现象,就以SARS-CoV-2疫苗的部署来说,在高收入和中等收入国家的覆盖率较高,而低收入国家的部署才刚刚开始。因此在疫苗的研发过程中,成本是必须要考虑的问题。此外,纳米颗粒疫苗研发平台需要专业的生产设施和高技能的劳动力,这对一些资源有限的国家也是一项挑战。最后是疫苗的运输与存储问题,目前大部分疫苗都需要冷链储存,这也使疫苗的生产、分销变得复杂。然而随着科技的进步,这些问题也在逐渐解决。总之,纳米颗粒疫苗是对抗传染性病毒的有效手段,相信在不久的将来,能够通过其改善全人类的生命健康。
猜你喜欢 抗原纳米颗粒 管式太阳能集热器的颗粒换热模拟材料与冶金学报(2022年2期)2022-08-10再也不怕打针的纳米微针军事文摘(2022年12期)2022-07-13神奇纳米纸少儿科技(2022年2期)2022-03-05负载抗原DC联合CIK对肝癌免疫微环境的影响昆明医科大学学报(2021年1期)2021-02-07植物增殖细胞核抗原的结构与功能数码世界(2018年1期)2018-12-23关于血型问题的释疑生物学教学(2018年10期)2018-11-29基于近场散射的颗粒粒径分布测量北京航空航天大学学报(2017年2期)2017-11-24APOBEC-3F和APOBEC-3G与乙肝核心抗原的相互作用研究癌变·畸变·突变(2015年3期)2015-02-27镇咳宁颗粒的质量标准研究中国民族民间医药·下半月(2014年4期)2014-09-26Huber集团的新型颗粒捕集器再生系统汽车与新动力(2014年2期)2014-02-27