周妙妮 林福全 吴辛刚 许爱娥
杭州市第三人民医院皮肤科310009
Fam114A1(family with sequence similarity 114 member A1)基因编码的蛋白属于Fam114 家族,又名为Noxp20,在神经细胞的发育中起重要作用[1]。Fam114A1 蛋白广泛分布于机体组织,包括皮肤组织,其基因突变与强直性脊柱炎及自身免疫性肠炎的发病有一定相关性[2],但均为基因水平的相关研究,在不同组织、细胞中生物学功能的研究目前尚未见报道。黑素细胞属于神经嵴来源的细胞,与神经细胞有一定的生物学共性,黑素细胞发育及功能异常会引起一系列色素性疾病,如泛发性色素异常症[3]、斑驳病[4]等。Fam114A1是否参与黑素细胞的发育以及功能调控,国内外尚未见报道。本文从多方面研究Fam114A1 基因对黑素瘤细胞A375 生物学功能的影响,初步探讨其对黑素细胞生物学功能可能的调控作用。
1.主要试剂和材料:A375细胞(天津赛尔生物技术有限公司);
胰蛋白酶、DMEM 培养基、Opti⁃MEM 培养基、胎牛血清(美国Gibco 公司);
磷酸甘油醛脱氢酶(GAPDH)、酪氨酸酶(TYR)、酪氨酸酶相关蛋白1(TYRP⁃1)、前黑素小体蛋白(PMEL)、小眼畸形相关转录因子(MITF)、多巴色素异构酶(DCT)、Fam114A1 抗体(美国BD 公司),MTT 细胞增殖检测试剂盒(美国Ameresco 公司),Transwell小室(美国Milipore公司)。
2. 建立稳定过表达和抑制Fam114A1 蛋白的A375 细胞株:构建Fam114A1 过表达质粒pSR⁃CMV⁃GFP/Fam114A1 和抑制质粒pRNT⁃U6.2⁃lenti⁃Fam114A1,并包被慢病毒,分别作为过表达组和表达抑制组,以转染空载慢病毒的A375 细胞作为对照组。慢病毒感染前1天接种2×105A375细胞于24 孔板,每孔细胞融合达60%~80%时,将病毒液(感染复数MOI=20)加入含8 μg/ml溴化己二甲铵的DMEM培养基24 h,之后更换为不含溴化己二甲铵的DMEM完全培养基。继续培养48 h,通过荧光显微镜观察慢病毒转染效率[绿色荧光蛋白(GFP)阳性细胞/总细胞数],然后裂解细胞检测Fam114a1蛋白表达量,验证过表达和抑制Fam114a1 蛋白的效果。再将对照组、过表达组和表达抑制组A375细胞分别稀释为1 000个/ml的单细胞悬液,用有限稀释法筛选获得能稳定过表达或抑制Fam114a1蛋白的A375单克隆细胞。单克隆细胞在完全培养基中继续培养,获得单克隆细胞系。
3.实时荧光定量PCR 检测黑素合成相关基因TYR、TYRP⁃1、PMEL、MITF、DCT mRNA 的表达:Trizol 法提取各组细胞总RNA。2 μg 总RNA 反转录成cDNA,再行荧光定量PCR 检测。引物由生工生物工程(上海)股份有限公司设计和合成,引物序列见表1。反应体系20 μl,反应条件:95 ℃预变性2 min,94 ℃变性1 min、60 ℃退火1 min、72 ℃延伸2 min,共30 个循环。以GAPDH 为内参,结果采用2-△△Ct表示,△Ct = Ct目的基因-Ct内参基因,△△Ct =△Ct过表达组或表达抑制组-△Ct对照组,每个样本重复3次,取平均值。

正向引物序列TGAAGGTCGGAGTCAACGGA GCAAAGCATACCATCAGCTCA TCTCTGGGCTGTATCTTCTTCC AGGTGCCTTTCTCCGTGAG CTCACAGCGTGTATTTTTCCCA AACTGCGAGCGGAAGAAACC反向引物序列CCTGGAAGATGGTGATGGGAT GCAGTGCATCCATTGACACAT GTCTGGGCAACACATACCACT AGCTTCAGCCAGATAGCCACT ACTTTCGGATATAGTCCACGGAT CGTAGTCGGGGTGTACTCTCT基因GAPDH TYR TYRP1 PMEL MITF DCT
4.Western 印迹法检测Fam114A1 及黑素合成相关蛋白的表达:提取各组细胞总蛋白,用含β 巯基乙醇5×上样缓冲液煮沸变性。取适量蛋白样品进行10%聚丙烯酰胺凝胶电泳,半干转膜。室温摇动封闭2 h,加入1∶1 000 TBST 缓冲液稀释的GAPDH、TYR、MITF、Fam114A1 抗体,4 ℃过夜。1×TBST 溶液洗膜4次,加入缓冲液稀释的辣根过氧化物酶标记羊抗兔IgG 二抗,室温作用1.5 h。1×TBST溶液洗膜4次,显色剂作用30 s后,暗室中曝光、显影和定影处理。用LabWorksTM凝胶成像及分析系统拍摄胶片,目的蛋白相对表达量=目的蛋白条带灰度值/GAPDH条带灰度值。
5.MTT 法检测A375 细胞增殖活性:将各组对数生长期细胞接种于96孔板,每组5孔,2 000个细胞/孔,48 h 后每孔加入10 g/L MTT 溶液10 μl。4 h后弃去原培养基,加入100 ml DMSO,摇床振荡10 min。在酶联免疫检测仪490 nm 波长处测量各孔A值(代表细胞增殖活性)。
6. 细胞迁移实验检测A375 细胞迁移能力:Transwell 小室底面涂0.5 g/L 纤维连接蛋白10 μl,超净台内风干备用。取105个细胞置于1.5 ml EP管中,200×g 离心5 min,去上清液,加入200 μl 无胎牛血清的DMEM 培养基重悬细胞,加入小室中。下层小室加入含20%胎牛血清的DMEM培养基,培养24 h后取出小室,彻底去除小室内层细胞。小室外层细胞用甲醇/冰醋酸(3∶1)固定30 min,结晶紫染色15 min。清洗干净并将膜固定于载玻片上,显微镜下选取3 个随机100 倍视野拍照并计数细胞,取平均值作为迁移的细胞数。
7. 细胞黏附实验检测A375 细胞黏附能力:0.2 g/L matrigel 胶包被96 孔板3 h,1×磷酸盐缓冲液(PBS)轻洗2 遍,每孔加入0.5%牛血清白蛋白100 μl,置37 ℃孵箱中封闭2 h,1 × PBS 轻洗2 遍备用。用胰酶消化细胞,调整细胞密度为2.5 ×104/100 μl,将细胞悬液滴加至96 孔板中,每组设3 个复孔,置37 ℃孵箱中继续培养,90 min 后去除培养基和悬浮细胞,MTT 法测定490 nm 处A 值(代表细胞黏附能力)。
8.统计学分析:采用SPSS 23.0软件分析数据,计量资料采用±s表示,多组的比较采用单因素方差分析,组间比较采用Dunnett⁃t检验,P<0.05认为差异有统计学意义。
1.稳定过表达和抑制Fam114A1 的A375 细胞株的建立:荧光显微镜观察慢病毒转染效率,对照组、过表达组和表达抑制组的转染效率均在90%左右,见图1A。Western 印迹结果显示,3 组A375 细胞中Fam114A1 蛋白相对表达差异有统计学意义(F=50.088,P=0.000 2),过表达组(1.507±0.170)显著高于对照组(0.850 ± 0.120,t = 5.888,P =0.001),表达抑制组(0.397 ± 0.120)显著低于对照组(t = 4.065,P = 0.007),见图1B。进一步筛选单克隆细胞,成功获得Fam114A1 稳定过表达和抑制的单克隆细胞株。

2. Fam114A1 对A375 细胞黑素合成相关基因mRNA 及蛋白表达的影响(图2):实时荧光定量PCR 结果显示,3 组间TYR 和MITF mRNA 相对表达差异有统计学意义(F = 43.052、39.460,P =0.000 3、0.000 4),而TYRP⁃1、PMEL、DCT mRNA 相对表达差异无统计学意义(F=3.005、2.535、0.886,P = 0.125、0.159、0.460)。表达抑制组TYR 和MITF mRNA 相对表达显著低于对照组(t=7.014、6.672,P<0.001、=0.001),而过表达组与对照组相比,差异无统计学意义(t=0.164、1.843,P=0.140、0.112)。见图2A。
Western 印迹结果显示,3 组间TYR 和MITF 蛋白表达差异有统计学意义(F=22.750、13.389,P=0.002、0.006),其中,表达抑制组显著低于对照组(t=4.421、4.269,P=0.004、0.005),而过表达组与对照组相比差异无统计学意义(t = 2.243、0.581,P=0.069、0.584)。见图2B、2C。
3. Fam114A1 对A375 细胞增殖活性的影响:MTT 法显示,培养48 h 后表达抑制组A375 细胞增殖活性显著高于对照组(t=3.812,P=0.009),但过表达组与对照组差异无统计学意义(t=0.541,P=0.572)。见表2。
4. Fam114A1 对A375 细胞迁移能力的影响:Transwell小室迁移实验显示,过表达组迁移细胞数量显著多于对照组,差异有统计学意义(t=3.110,P=0.021),而表达抑制组明显低于对照组,差异有统计学意义(t=4.242,P=0.005)。见图3、表2。
5. Fam114A1 对A375 细胞黏附能力的影响:MTT 法显示,表达抑制组细胞黏附能力高于对照组,差异有统计学意义(t=6.373,P=0.001),而过表达组与对照组相比差异无统计学意义(t=0.814,P=0.504)。见表2。
Fam114A1 基因位于人类第4 号染色体,包含14 个外显子,编码的蛋白主要在细胞质中表达。研究[1]显示,Fam114A1蛋白在小鼠大脑、脊髓等神经系统中高表达,并在小鼠胚胎发育的不同阶段差异表达,提示Fam114A1 可能与神经细胞的发育密切相关。黑素细胞与神经细胞共同起源于胚胎外胚层的神经嵴,而毛囊隆突区的神经嵴干细胞除了可以分化为神经元和神经胶质细胞,还可分化为黑素细胞[5]。Fam114A1是否参与黑素细胞的发育及功能调控,国内外尚未见报道。

细胞增殖活性(A值)0.706±0.035 0.917±0.110a 0.738±0.026 8.904 0.016迁移细胞数(个)267.000±30.200 185.700±11.400a 326.700±24.700b 27.313 0.001组别对照组表达抑制组过表达组F值P值细胞黏附能力(A值)0.524±0.035 0.733±0.045a 0.545±0.026 22.670 0.002
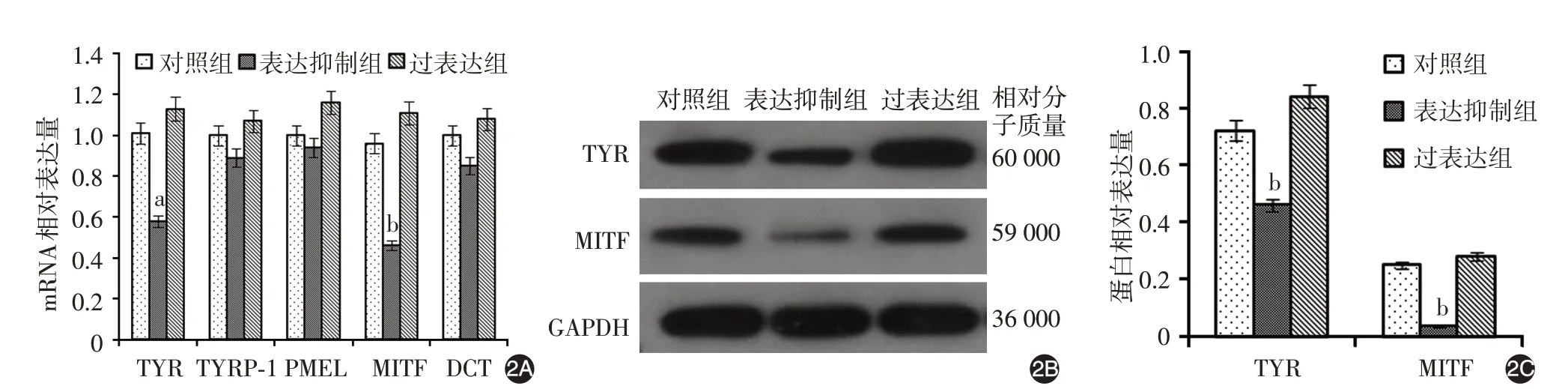

为研究Fam114A1 对黑素细胞生物学功能的影响,我们构建了稳定过表达及抑制Fam114A1 的A375单克隆细胞株。进一步细胞生物学功能研究显示,抑制Fam114A1表达可显著下调A375细胞中黑素合成相关蛋白TYR 和MITF 的表达。TYR 和MITF 是调控黑素合成的关键基因。MITF 可调节神经嵴细胞的定向分化和细胞周期进展,参与黑素细胞增殖及黑素化,调控色素合成限速酶相关基因TYR、TYRP⁃1 等表达,是黑素细胞生长存活、黑素生成的主要调节者[6]。MITF 和TYR 表达的下降,会引起黑素细胞黑素合成功能下降,使黑素合成减少,造成皮肤色素脱失[7]。本研究结果显示,Fam114A1可影响A375细胞中TYR和MITF蛋白的表达,提示其可能影响黑素细胞的生物学功能,参与调控黑素合成。
此外,我们还发现,Fam114A1蛋白表达的抑制可一定程度刺激A375 细胞的生长,增强其黏附能力,降低其迁移能力。当Fam114A1 蛋白过表达时,A375细胞的迁移能力显著增强,但对细胞生长和黏附能力无显著影响,这可能与A375 细胞本身的高增殖率和黏附能力有关。因此,有必要进一步用正常的黑素细胞验证Fam114A1 蛋白对其生长、黏附方面的影响。
综上所述,Fam114A1 蛋白对黑素瘤细胞系A375 的生物学功能有多方面的影响,如黑素合成和迁移能力,Fam114A1 可能是一种参与调控黑素细胞生物学活性的功能蛋白。
利益冲突所有作者均声明不存在利益冲突
猜你喜欢 黑素黑素细胞小室 黑素小体的结构及功能研究进展世界最新医学信息文摘(2022年36期)2022-10-29虾头变黑跟重金属无关保健与生活(2022年5期)2022-03-15开灯睡觉到底好不好?格言·校园版(2021年3期)2021-09-10卜算子·静夜思东坡赤壁诗词(2021年2期)2021-06-01“点痣”有风险 爱美须谨慎37°女人(2020年7期)2020-07-14日媒劝“灰小子”早日放开公主环球时报(2019-01-29)2019-01-29日本公主的准婆家靠谱吗?畅谈(2018年6期)2018-08-28异欧前胡素对人表皮黑素细胞酪氨酸酶和Rab27a的调节作用癌变·畸变·突变(2018年1期)2018-02-05黑素细胞悬液中加入透明质酸的最佳浓度选择中国美容医学(2004年1期)2004-08-11黑素小体转运的研究进展中国美容医学(2004年1期)2004-08-11