李 易 王 贺 张 曼 张严匀 张苗苗
正畸牙移动(orthodontic tooth movement, OTM)必然伴随着牙周组织的改建,OTM中压力侧细胞的死亡形式以及对牙周组织改建的影响机制是当前研究的热点。凋亡和坏死性凋亡均属于基因控制下的程序性细胞死亡,caspase8是外源性凋亡途径的起始caspase,当其被抑制或敲除,将激活坏死性凋亡途径,混合谱系激酶结构域样蛋白(mixed lineage kinase domain-like protein, MLKL)则是破坏细胞质膜完整性、执行坏死性凋亡的效应蛋白[1]。压力侧牙周组织改建主要表现为破骨细胞性骨吸收,现已发现多种与破骨细胞形成相关的信号转导机制,其中核因子κB受体活化因子配体(receptor activator of nuclear factor κB ligand, RANKL)信号通路在破骨细胞的分化诱导、激活和存活中发挥了关键作用[2]。
近年来研究表明,OTM中压力侧的牙周组织细胞可发生凋亡,并与破骨细胞的分化、募集有关[3,4]。课题组前期实验首次在压力侧牙周组织中发现部分细胞死亡是由坏死性凋亡介导[5]。虽然目前已对凋亡和坏死性凋亡信号通路做了深入研究,但是关于两者在OTM中的相互联系及对牙周组织改建的影响机制尚不完全清楚。本实验通过建立大鼠OTM模型,分别使用Nec-1和Z-VAD-FMK后观察caspase8、MLKL和RANKL在压力侧牙周组织中的变化,初步探讨压力侧牙周组织凋亡和坏死性凋亡的相互联系及对RANKL表达的影响。
1.主要材料与试剂:镍钛螺旋拉簧购自北京有研亿金新材料有限公司,粘接剂、流动树脂购自美国3M公司,正畸测力计购自杭州西湖生物材料有限公司,Nec-1、Z-VAD-FMK购自美国MedChemExpress公司,即用型正常山羊血清、DAB显色试剂盒、caspase8、RANKL抗体购自武汉博士德生物工程有限公司,MLKL抗体购自美国Affinity公司,兔二步法试剂盒购自北京中杉金桥生物技术有限公司。
2.实验动物及分组:80只7周龄健康雄性SD大鼠,体质量为200±10g,购自辽宁长生生物技术股份有限公司[实验动物许可证号:SCXK(辽)2020-0001,伦理审批号:2021084]。适应性喂养1周,采用随机数字表法分为对照组(C组)、加力组(F组)、加力+Nec-1组(FN组)、加力+Z-VAD-FMK组(FZ组),每组各20只。
3.动物模型的建立:10%的水合氯醛以0.3ml/100g的剂量腹腔注射麻醉大鼠,将其仰卧固定在实验台上,在上颌左侧第一磨牙和2颗上切牙之间用结扎丝固定1段镍钛拉簧,力量50g,建立以上颌2颗切牙为支抗拉左侧第一磨牙近中移动模型。C组无加力装置,F、FN、FZ组建立OTM模型,C组、F组于加力前半小时用微量进样器在大鼠上颌左侧第一磨牙颊腭侧牙龈黏膜局部注射50μl 0.9% NaCl溶液,FN组、FZ组以同样方式分别注射等体积1mmol/L的Nec-1和0.25mmol/L的Z-VAD-FMK,每隔2天注射1次。每天检查1次加力装置是否稳固,若有松动或脱落及时重新安置。
4.切片制备:获取上颌磨牙及牙槽骨的组织块,4%多聚甲醛溶液外固定48h,15%EDTA液(pH值为7.2)脱钙4周,脱水、透明、浸蜡、包埋、切片(厚5μm),光镜下挑选完整的切片用于苏木精-伊红(hematoxylin-eosin, HE)染色及免疫组化染色。
5.免疫组化染色及图像分析:烤片后进行脱蜡水化,抗原修复,血清封闭,分别滴加MLKL、caspase8、RANKL多克隆抗体4℃过夜,二抗37℃孵育20min,光镜下DAB显色观察,自来水冲洗终止,苏木精复染,氨水返蓝,脱水透明,封片。光镜下观察并截取图像,采用Image-Pro Plus 6.0软件对图像进行平均吸光度值测量。设定第1、3、5、7、14天5个时间点,观察每组大鼠对应的形态学改变,以及caspase8、MLKL、RANKL的免疫组化结果。
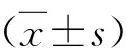
1.压力侧牙周组织的形态学改变:HE染色可见C组第一磨牙远中根压力侧牙周膜成纤维细胞排列规则,未见骨吸收陷窝。加力第1天时,牙周膜成纤维细胞排列紊乱;
第3天时,细胞数目明显减少,形成玻璃样变;
第5天起,出现破骨细胞及骨吸收陷窝,玻璃样变范围有所减少;
第7天时,玻璃样变基本清除;
第14天时,成纤维细胞排列规则,未见破骨细胞及骨吸收陷窝(图1)。

图1 压力侧牙周组织的变化(HE染色,×200)A.C组第7天;
B.F组第1天;
C.F组第3天;
D.F组第5天;
E.F组第7天;
F.F组第14天。R.牙根;
PDL.牙周膜;
AB.牙槽骨;
白色箭头示玻璃样变;
黑色箭头示破骨细胞
2.caspase8的免疫组化结果:C组各时间点caspase8的表达比较差异无统计学意义(P>0.05)。F、FN、FZ组第1、3、5、7天的表达均高于C组(P<0.05)。F组中caspase8的表达随加力时间逐渐增加,第3天达到高峰,之后减少。FN组各时间点的表达与相应F组中的表达比较,差异均无统计学意义(P>0.05)。与F组和FN组比较,FZ组各时间点的表达明显降低(P<0.05),详见图2、表1。

表1 各组大鼠不同时间点第一磨牙压力侧牙周组织caspase8表达的平均吸光度值

图2 各组大鼠第3天时caspase8的表达情况(免疫组化染色,×200)A.C组第3天;
B.F组第3天;
C.FN组第3天;
D.FZ组第3天。R.牙根;
PDL.牙周膜;
AB.牙槽骨
3.MLKL的免疫组化结果:C组各时间点MLKL的表达比较,差异无统计学意义(P>0.05)。F组第1、3、5天的表达均较C组增强,加力第1天时即达到表达高峰,随着加力时间延长呈降低趋势。FN组第1、3天的表达较C组增强;
第1、3、5天的表达与相应F组中的表达比较显著降低(P<0.05)。FZ组第1、3、5天的表达均较C、F、FN组增强(P<0.05)。第7、14天各组MLKL的表达比较,差异均无统计学意义(P>0.05),详见图3、表2。

表2 各组大鼠不同时间点第一磨牙压力侧牙周组织MLKL表达的平均吸光度值

图3 各组大鼠第1天时MLKL的表达情况(免疫组化染色,×200)A.C组第1天;
B.F组第1天;
C.FN组第1天;
D.FZ组第1天;
R.牙根;
PDL.牙周膜;
AB.牙槽骨
4.RANKL的免疫组化结果:C组各时间点RANKL的表达比较,差异无统计学意义(P>0.05)。F组RANKL表达随加力时间逐渐增加,第5天达到高峰,之后减少,各时间点的表达均高于C组(P<0.05)。FN组第1、3、5、7天的表达较F组减少,但较C组增多(P<0.05)。FZ组第3、5、7天的表达较F、FN组减少(P<0.05)。第14天时,F、FN、FZ组RANKL的表达比较,差异无统计学意义(P>0.05),但均高于C组(P<0.05),详见图4、表3。

图4 各组大鼠第5天时RANKL的表达情况(免疫组化染色,×200)A.C组第5天;
B.F组第5天;
C.FN组第5天;
D.FZ组第5天。R.牙根;
PDL.牙周膜;
AB.牙槽骨

表3 各组大鼠不同时间点第一磨牙压力侧牙周组织RANKL表达的平均吸光度值
凋亡介导的细胞死亡与caspase家族活化密切相关,caspase8是外源性凋亡途径的启动caspase,进而激活下游caspase3执行凋亡活动。MLKL是坏死性凋亡发生的关键,磷酸化的MLKL发生寡聚并转移至质膜,破坏质膜完整性导致细胞坏死[6]。本实验观察到牙周组织在加力第1天时即出现明显的caspase8表达,第3天时达到表达高峰,MLKL同样在加力第1天时出现明显表达,之后便呈降低趋势,提示牙周组织细胞凋亡和坏死性凋亡主要发生在正畸加力初期。同时,caspase8的表达也说明了压力侧牙周组织凋亡可以通过外源性凋亡途径激活。但一些研究观察到caspase3在牙齿移动7天后仍有增加,由于caspase3是多条凋亡途径下游共同的效应蛋白酶,因此细胞凋亡可能存在于整个OTM过程中且涉及多条凋亡信号通路,而外源性凋亡途径可能主要介导了牙齿移动早期的凋亡发生[7]。
研究表明,Z-VAD-FMK在抑制caspase8活性阻断凋亡发生的同时可以增强坏死性凋亡[8]。本实验使用Z-VAD-FMK后,caspase8表达早期明显降低,MLKL表达明显升高,这一结果与上述研究一致。Nec-1通过变构抑制受体相互作用蛋白1(receptor-interacting protein1, RIP1)激酶活性从而有效抑制坏死性凋亡,但是否影响凋亡目前的研究仍有争议[9]。本实验使用Nec-1后,MLKL水平明显降低,caspase8水平无明显变化,说明Nec-1可以抑制MLKL的表达而对caspase8的表达无影响,但由于凋亡信号通路复杂,且本实验检测指标有限,仅caspase8的表达不足以完全反映凋亡水平,因此Nec-1对OTM牙周组织细胞凋亡的影响仍需进一步研究。
RANKL是一种来自肿瘤坏死因子(tumour necrosis factor, TNF)家族的膜相关细胞因子,在牙周组织中可以由成骨细胞、成纤维细胞、骨细胞以及成牙骨质细胞分泌,与破骨前体细胞表面的核因子κB受体活化因子(receptor activator of nuclear factor κB, RANK)结合,通过激活核因子κB(nuclear factor kappa B, NF-κB)和丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)等下游信号通路诱导破骨细胞分化成熟[10~14]。研究表明,压应力可以上调牙周组织中RANKL的表达水平,并与caspase3的表达呈正相关[4]。Kaplan等[3]利用双磷酸盐类似物IG9402抑制骨细胞凋亡发现会阻碍破骨细胞和巨噬细胞的形成,认为牙周膜细胞凋亡和骨细胞凋亡在OTM骨吸收中发挥了同等重要的作用。本实验正畸加力后观察到RANKL表达以时间依赖性的方式增加,加力第5天时达到表达高峰,随后逐渐减少。使用凋亡抑制剂Z-VAD-FMK后,第1、3、5、7天的RANKL表达较加力组显著减少,提示牙周组织细胞凋亡可以上调RANKL表达以促进破骨细胞生成。
不同于凋亡,坏死性凋亡使质膜破裂导致细胞内容物释放进而启动非感染性炎性反应,此外RIP1和RIP3也可直接产生炎性细胞因子[15]。本实验使用坏死性凋亡抑制剂Nec-1后,第1、3、5、7天的RANKL表达较加力组明显减少,说明坏死性凋亡参与了压力侧牙周组织上调RANKL的过程,这可能与坏死性凋亡介导的炎性反应有关。据报道,炎性细胞因子如TNF-α,既可以刺激间充质细胞分泌RANKL,又可以协同RANKL作用于RANK,增强破骨细胞生成的信号转导[16,17]。抑制坏死性凋亡可以通过减轻炎性反应进而削弱破骨细胞的形成能力。然而,坏死性凋亡对破骨细胞的调控作用似乎是有限的,因为FZ组尽管增强了坏死性凋亡,但RANKL表达均较F组和FN组减少,可能是由于抑制凋亡后牙周组织发生过多坏死,致使分泌RANKL的细胞来源减少。这也进一步说明了破骨细胞分化必须存在RANKL和RANK,虽然坏死性凋亡引起了炎性反应增加,但是在缺乏RANKL和RANK的条件下炎性细胞因子无法独立诱导破骨细胞形成[17]。
综上所述,OTM中压力侧牙周组织可同时发生凋亡和坏死性凋亡,抑制凋亡可以促进坏死性凋亡。此外,两者均可引起压力侧牙周组织RANKL高表达,参与牙周组织改建,为进一步研究正畸力作用下细胞死亡对牙周组织改建的影响机制奠定了基础。
猜你喜欢牙周膜牙周组织坏死性禽坏死性肠炎和冠状病毒性肠炎的分析、诊断和防控现代畜牧科技(2021年9期)2021-10-13牙周膜干细胞BMP-2-PSH复合膜修复新西兰兔牙槽骨缺损昆明医科大学学报(2021年5期)2021-07-22维生素C对牙周膜干细胞中HDAC1和HDAC6表达的影响天津医科大学学报(2021年2期)2021-03-29儿童坏死性肺炎46例临床分析昆明医科大学学报(2021年1期)2021-02-07牙周组织再生术与正畸联合治疗牙周炎患者临床效果分析中华养生保健(2020年3期)2020-11-16两种培养条件对牙周膜干细胞生物学特性影响的对比研究中华老年口腔医学杂志(2016年2期)2017-01-15鼻内镜下手术治疗上颌窦出血坏死性息肉的临床观察转化医学电子杂志(2015年4期)2015-12-27牙周组织再生术联合正畸治疗牙周炎的临床效果中国医疗美容(2015年1期)2015-07-12高金合金和镍铬合金冠桥修复体对牙周组织远期影响的比较中国当代医药(2015年32期)2015-03-01自分泌因子对牙周膜干细胞影响的研究进展西南军医(2015年1期)2015-01-22