李小宇,梁政伟,秦思,张倩,张俊诗,丁菁,陆德琴*
(贵州省常见慢性疾病发病机制及药物防治研究重点实验室,贵州 贵阳 550025;
贵州医科大学 基础医学院 病理生理学教研室,贵州 贵阳 550025)
由内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)催化产生的一氧化氮(nitric oxide,NO)是维持血管内皮功能的一个重要因子。eNOS酶活性调控机制中蛋白质翻译后磷酸化修饰是重要机制之一,目前已知eNOS有Ser114、Thr495、Ser615、Ser633和Ser1177等5个丝/苏氨酸磷酸化调控位点[1],其中Ser633[2]和eNOS Ser1177[3]位点磷酸化增加均可增强eNOS活性。eNOS Ser1177磷酸化已被广泛研究,其调控机制比较清楚[4]。eNOS Ser633可在细胞内钙浓度不改变的条件下发生磷酸化且持续时间较eNOS Ser1177更长,因此可更有效地增强eNOS活性[5]。现有研究表明,蛋白激酶 A (PKA)、Pim1激酶、AMP 活化蛋白激酶 (AMPK)、细胞外信号调节激酶 (ERK) 1以及ERK2等蛋白激酶可使eNOS Ser633磷酸化而激活eNOS[5],但对调控该位点去磷酸化的蛋白磷酸酶了解甚少。蛋白丝氨酸/苏氨酸磷酸酶家族包括蛋白磷酸酶1(protein phosphatase 1,PP1)、PP2A、PP2B、PP2C以及PP5等[6],PP2A又包含3个家族成员PP2A、PP4以及PP6,3者分子结构和酶学特性相似、氨基酸序列高度同源[7],PP2A家族成员负责细胞内大多数蛋白质的Ser/Thr位点去磷酸化调控[8]。已经明确PP2A能直接使eNOS Ser1177去磷酸化[9],PP2A激活后下调eNOS Ser1177磷酸化水平,降低细胞内NO含量,可导致内皮功能障碍[10-11]。然而,对于eNOS Ser633去磷酸化调控,迄今仍不清楚。游离脂肪酸(free fatty acids,FFAs),即非酯化脂肪酸,是体内的一种能源物质,当血浆FFAs异常升高会造成内皮功能损害[12-13],诱导eNOS功能障碍,细胞凋亡增加,从而发生氧化应激和炎症反应[14-15]。棕榈酸(palmitic acid,PA)是一种饱和脂肪酸,是血液中含量最高的FFAs。已有研究报道,PA通过激活PP2A减少eNOS Ser1177磷酸化、降低eNOS活性以及细胞内NO含量[16]。本课题组前期研究发现PA还可激活PP2A家族中的PP4导致eNOS Ser633磷酸化水平降低,细胞内NO含量减少[17],但具体分子机制尚不清楚。本研究将进一步验证PA激活PP4下调eNOS Ser633磷酸化水平的作用,深入探讨PA激活PP4的分子机制,旨在进一步阐明游离脂肪酸损害内皮功能的分子机制,并完善eNOS 磷酸化调控机制,为防治内皮功能障碍介导的心血管系统疾病提供新靶点、新思路。
1.1 材料
1.1.1细胞株 人脐静脉内皮细胞(HUVECs),购自上海富衡生物科技有限公司。
1.1.2主要仪器 凝胶成像系统(上海天能科技有限公司),电泳仪、转膜仪(北京六一生物科技有限公司),CO2细胞培养箱(美国Thermo Fisher 公司),高速低温离心机(美国Beckman Coulter 公司),正置显微镜、倒置荧光显微镜(日本Olympus公司),超净工作台(美国Thermo Fisher 公司)。
1.1.3主要药物、试剂 PA、福司曲星(fostriecin,FST),N-乙酰半胱氨酸(N-acetylcysteine,NAC)以及夹竹桃素(apocynin,APO;
美国Sigma公司),3-氨基-5-氨基甲基-2′,7′-二荧光素二乙酸酯(DAF-FM DA;
美国Med Chem Express),2,7-二氯二氢荧光素二乙酸酯(DCFH-DA;
中国南京建成公司),鼠抗人eNOS和eNOS Ser633抗体(美国BD公司),兔抗人PP4R2抗体和兔抗人PP4c抗体(武汉三鹰生物技术有限公司),兔抗鼠PP2Ac抗体(美国Abcam公司),兔抗鼠gp91phox抗体(美国Santa Cruz 公司),抗β-tubulin抗体、HRP标记的羊抗鼠二抗以及HRP标记的羊抗兔二抗(武汉普美克生物技术有限公司),特异性PP4c siRNA、特异性PP2Ac siRNA以及特异性gp91phox siRNA (中国上海吉玛公司),LipofectamineTM3000(美国Invitrogen公司)。PVDF膜(美国Millipore公司),ECL化学发光液(天津天地人和生物科技有限公司),BCA蛋白检测试剂盒、RPMI 1640培养基(中国赛默飞世尔公司),胎牛血清(FBS;
以色列Biological Industries公司),0.25%胰蛋白酶和青霉素-链霉素(美国HyClone公司),RIPA裂解缓冲液(中国Solarbio公司),基质胶(美国康宁公司)。
1.2 方法
1.2.1细胞培养与分组 HUVECs用含有10%胎牛血清和1%青霉素/链霉素的RPMI 1640培养基,于37 ℃、5%CO2的加湿培养箱中进行培养,每2 d更换1次培养基。当细胞生长至约90%融合时,按1 ∶3比例传代,取4~12代细胞进行实验。将细胞分为Control组、PA处理组(分为25、50、100以及200 μmol/L PA处理36 h,100 μ mol/L PA处理12、24、36以及48 h)、FST预处理组、FST预处理+PA组、si-Control组、si-Control+PA组、si-PP2Ac组、si-PP4c组、si-PP2Ac+PA组、si-PP4c+PA组、Vector组、OE-PP4R2组、Vector+PA组、OE-PP4R2+PA组、NAC预处理组、APO预处理组、NAC预处理+PA组、APO预处理+PA组、si-gp91phox组及si-gp91phox组。
1.2.2配制 PA PA需在70 ℃溶解于0.1 mol/L NaOH中,先配制成60 mmol/L浓度,然后以1 ∶9比例用10%BSA稀释,获得6 mmol/L PA储备液,过滤除菌后储存于-20 ℃备用。
1.2.3PP4抑制剂和抗氧化剂预处理HUVECs 将PP4抑制剂FST和抗氧化剂NAC和APO分别溶于DMSO,-20 ℃保存。预处理HUVECs时终浓度分别选用FST为20 nmol/L、NAC为1mmol/L、APO为20 μmol/L,时间均为30 min。
1.2.4蛋白免疫印迹分析(Western blot)检测eNOS总蛋白、eNOS Ser633、PP2Ac、PP4c、PP4R2、gp91phox蛋白质表达 于冰上用RIPA裂解缓冲液提取细胞总蛋白,然后4 ℃,12 000 r/min离心25 min,收集上清液,用BCA蛋白测定试剂盒测定蛋白浓度。蛋白质通过10%的SDS-PAGE分离,转移到PVDF膜上,并于室温用5%脱脂牛奶封闭1 h后将膜与一抗在4 ℃孵育过夜。次日将PVDF膜用TBST洗3次,每次10 min,然后与二抗在室温孵育1 h,TBST洗3次,每次10 min,目的蛋白条带用ECL液显影。用凝胶成像系统中采集蛋白条带图片,Image J软件进行条带积分吸光度(A)值分析。结果以β-tubulin为内参照,以目的条带与内参照条带积分吸光度值的比值表示,至少重复3批次独立实验,每批次样品重复检测3次。
1.2.5一氧化氮(NO)的测定 用荧光探针DAF-FM DA进行细胞内NO产量测定,按说明书操作。用磷酸盐缓冲液(PBS)洗涤细胞后,将荧光探针按1 ∶500比例稀释到无血清和无酚红培养基中,并加入细胞中,37 ℃、5%CO2培养箱中培养30 min。使用奥林巴斯显微镜(IX71,日本)观察荧光并拍照,荧光强度采用Image J软件进行分析。
1.2.6活性氧(ROS)测定 用ROS荧光探针DCFH-DA检测细胞内ROS含量,按照说明进行操作。将荧光探针按1 ∶2 000比例稀释到无血清和无酚红培养基中,加入到细胞中37 ℃、5%CO2的培养箱中孵育30 min。用PBS清洗细胞3次,采用Olympus(IX71,日本)显微镜观察荧光并拍照,荧光强度采用Image J软件进行分析。
1.2.7siRNA转染 特异性siRNA购自上海吉玛公司。核苷酸序列如下:PP4c,正义链5′-GGACGAGCAUCUCCAGAAATT-3′,反义链 5′-CCUGCUCGUAGAGGUCUUUTT-3′;
PP2Ac,正义链 5′-GAUACAAAUUACUUGUUUATT-3′,反义链 5′-UAAACAAGUAAUUUGUAUC-3′;
gp91phox,正义链 5′-GGCUGUGCAUAAUAUAACATT-3′,反义链 5′-UGUUAUAUUAUGCACAGCCTT-3′。将HUVECs接种在6孔板中,当细胞密度达到40%~50%时进行转染。根据LipofectamineTM 3000转染试剂说明书,将PP4c siRNA、PP2Ac siRNA、gp91phox siRNA分别转染至HUVECs;
转染6 h后,更换新鲜完全培养基,加或不加PA继续培养36 h。
1.2.8慢病毒包装、感染并获得稳转细胞株 pHJPLV-CMV-PP4R2-RFP-T2A-PURO慢病毒过表达PP4R2质粒由贵州禾晋生物公司提供。用293T细胞包装慢病毒:将293T细胞接种于100 mm细胞培养皿中,待细胞密度达到50%~60%时更换无血清培养基培养1 h,然后按目的质粒 ∶pSPAX2质粒 ∶pMD2G质粒=4.4 μg ∶3.325 μg ∶2.225 μg比例加入150 μL DMEM培养基,混匀后室温静置5 min,同时取PEI 24 μL加入150 μL DMEM培养基,混匀,室温静置5 min后逐滴加入质粒混合液中,再混匀得到工作液,室温静置25 min;
然后将工作液逐滴加入培养皿,混匀,37 ℃、5%CO2培养,6~8 h后换液继续培养,72 h后收取病毒上清,3 000 r/min离心10 min,0.45 μm滤器过滤,直接感染HUVECs,同时感染空载病毒组作为对照。感染后72 h用倒置荧光显微镜观察荧光情况,确定感染效率,并用嘌呤霉素筛选稳定株,得到PP4R2过表达稳转HUVECs细胞株用于后续研究。
1.2.9细胞划痕实验检测细胞迁移能力 提前用标记笔于6孔板底部画好横线,将对数生长期的 HUVECs 接种于 6孔板 (每孔 5×105个细胞),待细胞铺满培养皿融合成单层细胞后,用200μL枪头在培养孔中沿横线划一条直线,用PBS清洗细胞2遍,加入含2%FBS培养基继续培养。通过倒置显微镜观察0、6、12以及24 h时细胞划痕的愈合情况,并在各时间点分别随机选择6个100倍视野拍照,用Image J软件进行分析,计算细胞迁移率,迁移率=(0 h距离-相应时间点距离)/0 h距离。
1.3 统计学方法

2.1 PA诱导eNOS Ser633磷酸化水平下调,减少细胞内NO生成
HUVECs分别用25、50、100及200 μmol/L PA处理36 h后,各组间eNOS蛋白总表达水平比较,差异无统计学意义(P>0.05);
但从50 μmol/L PA组开始eNOS Ser633磷酸化水平较Control组降低(P<0.05),并呈浓度依赖效应。100 μ mol/L PA处理12、24、36以及48 h后,各组间eNOS蛋白总表达水平比较,差异无统计学意义(P>0.05),但从24 h开始eNOS Ser633磷酸化水平较Control组降低(P<0.05),并呈时间依赖效应。后续实验选择100 μmol/L PA处理36 h作为干预条件,DAF-FM DA 荧光探针检测细胞内NO产量,显示PA组细胞产生NO减少(P<0.05)。见图1。
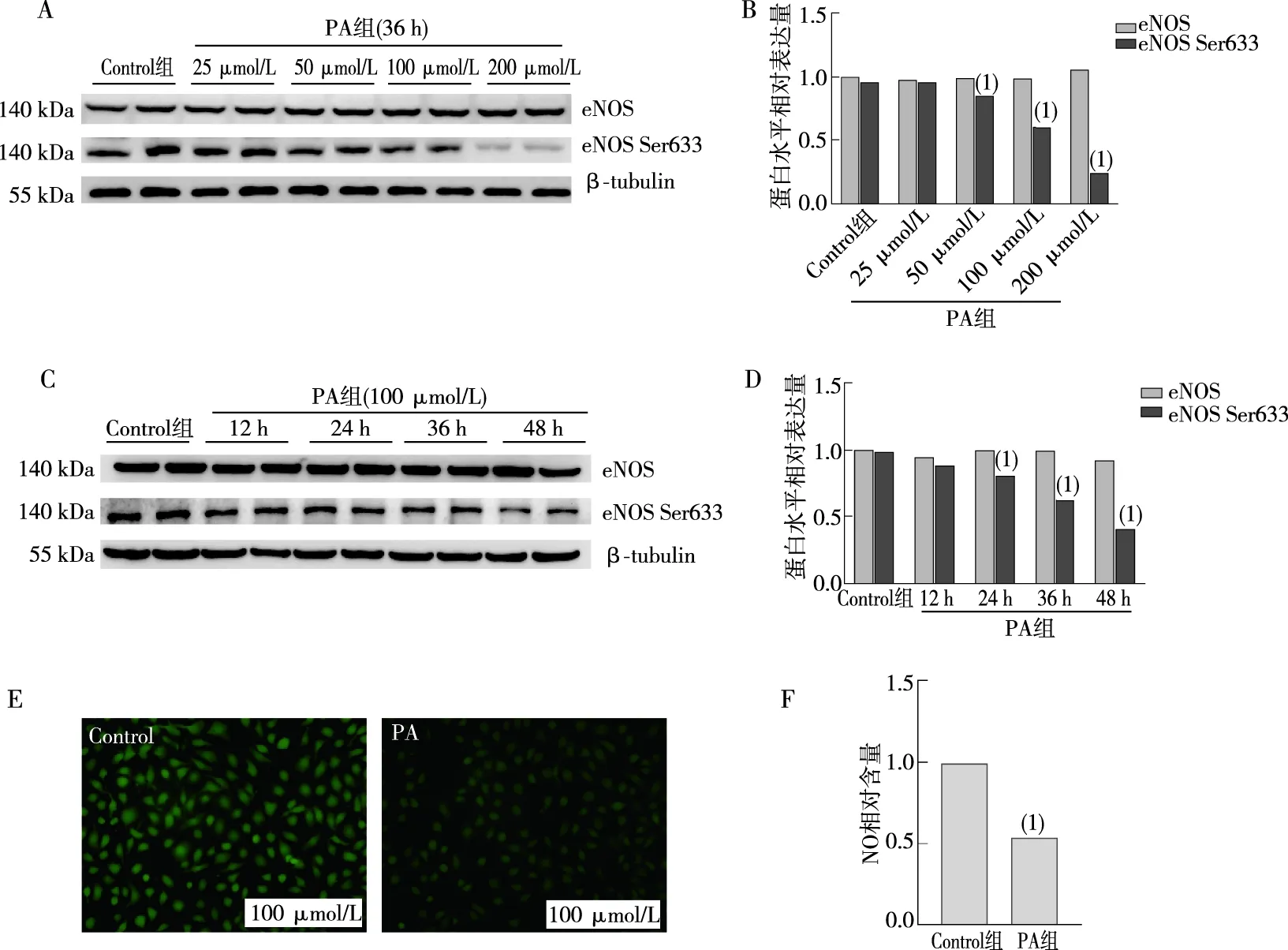
注:A为不同PA浓度处理36 h对eNOS Ser633磷酸化水平的影响,B为蛋白水平相对表达量统计图,C为100 μmol/L PA处理不同时间对eNOS Ser633磷酸化水平的影响,D为蛋白水平相对表达量统计图,E为NO荧光表达水平,F为NO相对含量统计图;
(1)与Control组相比,P<0.05。图1 PA对HUVECs的eNOS Ser633磷酸化以及NO生成的影响Fig.1 Effect of PA on phospho-Ser633-eNOS level and NO production in HUVECs
2.2 PA通过激活PP4诱导eNOS Ser633磷酸化水平降低
Western blot结果显示,FST预处理可抑制PA诱导eNOS Ser633磷酸化水平降低(P<0.05),而eNOS总蛋白表达水平不受影响(P>0.05)。FST预处理后PA降低细胞内NO产量的作用也被抑制(P<0.05)。当敲低PP4c亚基后,eNOS Ser633磷酸化水平增加(P<0.05)。而敲低PP2Ac亚基对eNOS Ser633磷酸化水平无明显影响(P>0.05)。各组eNOS总蛋白表达比较,差异无统计学意义(P>0.05)。上述结果提示,PA通过激活PP4(而不是PP2A),下调eNOS Ser633磷酸化。见图2。
2.3 PA通过降低 PP4R2 调节亚基蛋白表达水平激活PP4 导致 eNOS Ser633 磷酸化水平降低
Western blot检测结果显示,PA虽然不影响PP4催化亚基PP4c蛋白表达水平,但能抑制PP4调节亚基PP4R2的蛋白表达(P<0.05)。利用慢病毒过表达PP4R2质粒转染HUVECs,特异性过表达PP4R2加以验证,过表达PP4R2可逆转PA诱导的eNOS Ser633的磷酸化水平降低(P<0.05);
且细胞内NO的含量明显增加,内皮细胞迁移能力增加(P>0.05)。上述结果提示,PA通过抑制PP4R2调节亚基蛋白表达水平诱导PP4激活,从而降低eNOS Ser633磷酸化。细胞内NO产生减少,内皮细胞出现功能障碍。见图3。

注:A为PP4抑制剂FST对 eNOS Ser633磷酸化水平的影响,B为蛋白水平相对表达量统计图,C为PP4抑制剂FST对NO生成的影响,D为NO相对含量统计图,E为敲低PP4c亚基对eNOS Ser633磷酸化水平的影响,F为蛋白水平相对表达量统计图,G为敲低PP2Ac亚基对eNOS Ser633磷酸化水平的影响,H为蛋白水平相对表达量统计图;
(1)与Control组相比,P<0.05;
(2)与PA组相比,P<0.05;
(3)与si-Control组相比,P<0.05;
(4)与si-PP4c组相比,P<0.05;
(5)与si-Control+PA组相比,P<0.05;
(6)与si-PP2Ac组相比,P<0.05。图2 抑制PP2A、PP4活性以及敲低PP2Ac亚基、PP4c亚基对eNOS Ser633磷酸化水平以及NO产量的影响Fig.2 Effect of inhibiting PP2A and PP4 activity as well as knockdown of PP2Ac and PP4c on phospho-Ser633-eNOS level and NO production
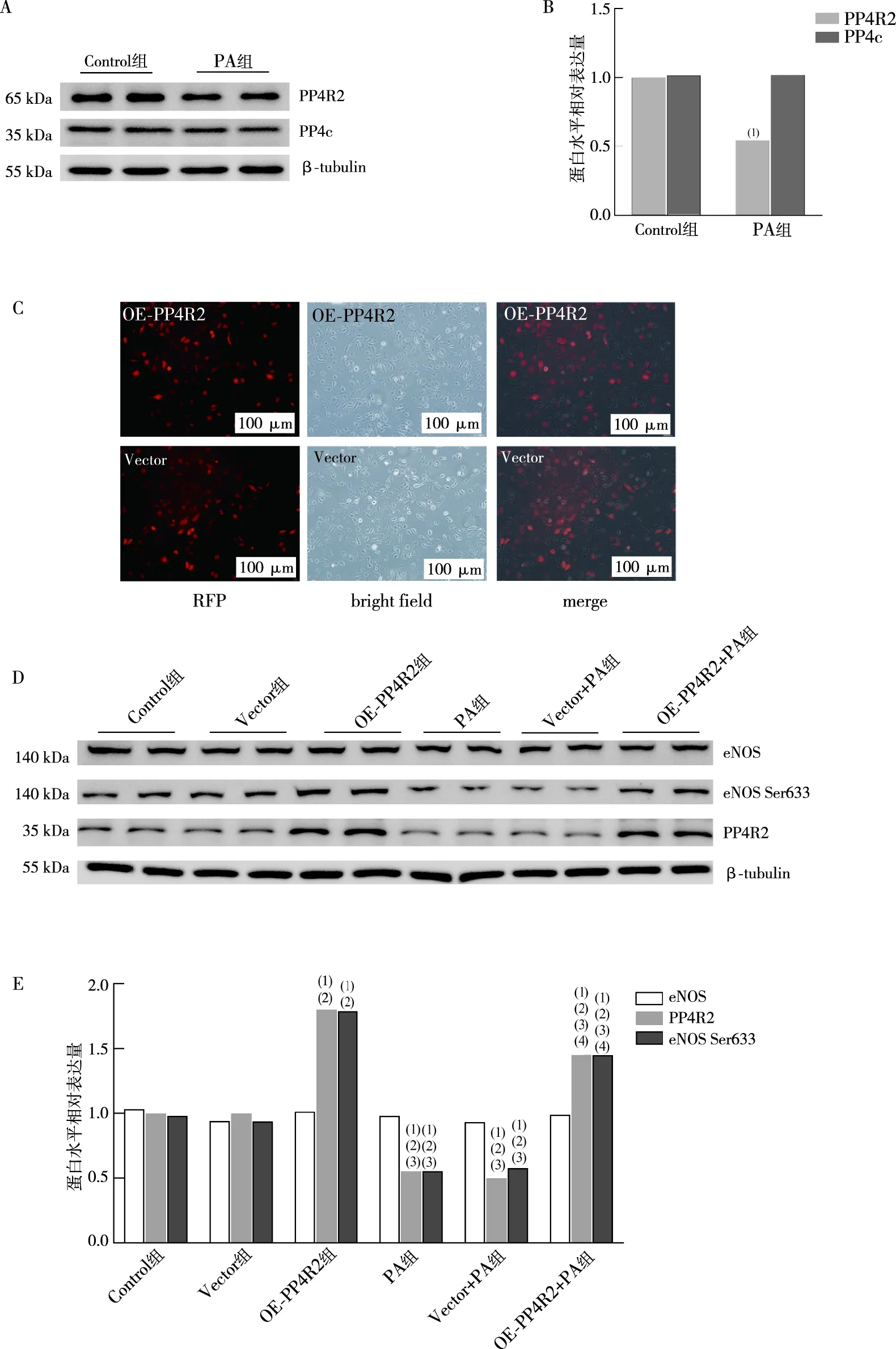
注:A为PA对PP4c亚基和PP4R2亚基蛋白表达水平影响,B为蛋白水平相对表达量统计图;
C为成功感染慢病毒过表达PP4R2质粒,D过表达PP4R2蛋白对eNOS Ser633的磷酸化水平影响,E为蛋白水平相对表达量统计图;
(1)与Control组相比,P<0.05;
(2)与Vector组相比,P<0.05;
(3)与OE-PP4R2组相比,P<0.05;
(4)与Vector+PA组相比,P<0.05。图3 过表达PP4R2亚基对eNOS Ser633磷酸化的影响Fig.3 The effect of PP4R2 subunit overexpression on on eNOS Ser633 phosphorylation
2.4 过表达PP4R2调节亚基蛋白改善 PA对HUVEC细胞功能的抑制作用
DAF-FM DA 荧光探针检测细胞内NO产量,结果显示PA组细胞产生NO减少(P<0.05),OE-PP4R2+PA组细胞产生NO显著增加(P<0.05)。细胞划痕实验观察过表达PP4R2调节亚基蛋白对PA刺激HUVEC的迁移能力的影响,结果显示过PA组内皮细胞迁移能力被抑制(P<0.05),而OE-PP4R2+PA组细胞迁移能力较PA组显著增强。见图4。
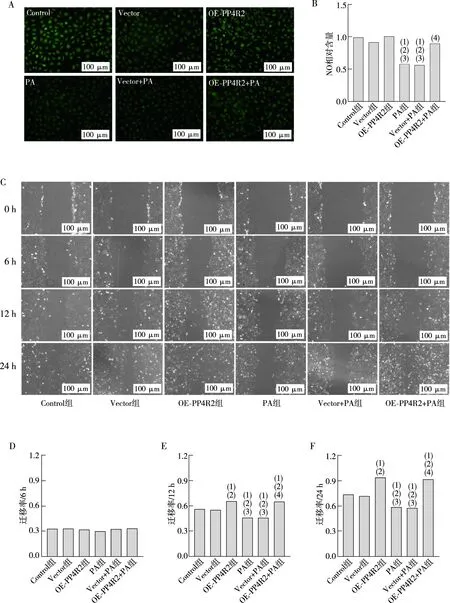
注:A为过表达PP4R2蛋白对细胞内NO生成影响,B为NO相对含量统计图;
C为过表达PP4R2蛋白对细胞迁移能力影响,D为细胞划痕6 h的迁移率统计图,E为细胞划痕12 h的迁移率统计图,F为细胞划痕24 h的迁移率统计图;
(1)与Control组相比,P<0.05;
(2)与Vector组相比,P<0.05;
(3)与OE-PP4R2组相比,P<0.05;(4)与Vector+PA组相比,P<0.05。图4 过表达PP4R2亚基对NO生产以及细胞迁移功能的影响Fig.4 The effect of PP4R2 subunit overexpression on NO production and cell migration function
2.5 PA通过 Nox/ROS 通路降低 PP4R2 蛋白水平,继而下调 eNOS Ser633 磷酸化水平
通过 Westem Blot 检测 NADPH 氧化酵但化亚基gp91phox,结果发现 PA 增加 gp9lphox 的蛋白表达(P<0.05)。使用抗氧化剂NAC(1 mmoVL 或 20 μmo/L)APO 预处理 HU-VECs,结果显示 PA 处理后 ROS 含量高于 Control组(P<0.05),NAC 或 APO 预处理后 ROS 含量降低(P<0.05)。Western Blot 结果表明,NAC 或 APO 预处理均可复 PP4R2 蛋白表达水平以及 eNOS Se633 磷酸化水平(P<005)但不影响各组间 PP4e 亚基蛋白表达水平。特异性 siRNA 低 gp9lphox 亚基后可逆转 PA 诱导的 PP4R2 蛋白表达水平降低及eNOS Ser633 磷酸化水平下降(P<0.05),但不影响 PPc 亚基蛋白表达水平。上述结果表明,PA 可能通过 Nox/ROS 通路降低 PP4R2 蛋白表达水平,从而激活 PP4,降低 eNOS Ser633 磷酸化水平。见图5、图6。

注:A为PA对Nox催化亚基gp91phox蛋白表达的影响,B为蛋白水平相对表达量统计图,C为NAC和APO对PA刺激后细胞内ROS产量的影响,D为ROS相对含量统计图,E为NAC对 PA刺激后PP4R2亚基蛋白表达以及eNOS Ser633磷酸化水平的影响,F为蛋白水平相对表达量统计图,G为APO对 PA刺激后PP4R2亚基蛋白表达以及eNOS Ser633磷酸化水平的影响,H为蛋白水平相对表达量统计图;
(1)与Control组相比,P<0.05;
(2)与PA组相比,P<0.05。图5 Nox/ROS通路对PA降低PP4R2亚基蛋白表达水平以及eNOS Ser633磷酸化水平的影响Fig.5 Effect of the Nox/ROS pathway on PA-mediated decrease of PP4R2 protein expression and phospho-Ser633-eNOS levels

注:A为敲低gp91phox对eNOS Ser633磷酸化水平、PP4R2亚基以及PP4c亚基蛋白表达的影响,B为蛋白水平相对表达量统计图;
(1)与Control组相比,P<0.05;
(2)与PA组相比,P<0.05;
(3)与si-Control组相比,P<0.05;
(4)与si-gp91phox组相比,P<0.05。图6 Nox对PA降低PP4R2亚基蛋白表达水平及eNOS Ser633磷酸化水平的影响Fig.6 Effect of the Nox on PA-mediated decrease of PP4R2 protein expression and phospho-Ser633-eNOS levels
内皮功能障碍的重要表现之一是eNOS酶活性降低、内皮细胞产生NO减少。eNOS酶活性可在转录水平、翻译水平、翻译后水平进行调控,翻译后的调控机制中蛋白磷酸化修饰是其中一个重要方式,eNOS Ser633和eNOS Ser1177是可增强eNOS活性的两个重要的磷酸化调控丝氨酸位点[18-19]。eNOS Ser1177磷酸化快速且依赖于钙,已被公认是eNOS激活的主要原因之一。有研究认为,eNOS Ser633是eNOS Ser1177发生早期磷酸化后,在不依赖细胞内钙水平的情况下持续维持eNOS活性,持续增加NO产量的主要原因[20-21]。目前关于eNOS Ser1177磷酸化调控的研究报道较多,而eNOS Ser633磷酸化调控机制研究报道较少,尤其是其去磷酸化调控机制尚未见报道,本研究将进一步揭示eNOS Ser633去磷酸化调控机制,对进一步阐明内皮功能及其功能障碍分子机制具有显著的病理生理学意义。
丝氨酸/苏氨酸磷酸酶在细胞内调控绝大多数蛋白质的去磷酸化过程,其中 90%的丝氨酸和苏氨酸的去磷酸化归因于 PP1和PP2A[22]。PP2A在eNOS的磷酸化调节中起着重要作用,PP2A亚家族包含3个主要成员,PP2A、PP4及PP6。已有研究表明PA可激活PP2A,下调eNOS Ser1177磷酸化水平,降低NO产生[16,23]。本课题组前期研究发现PA还可激活PP2A家族中的PP4,而不是PP2A导致eNOS Ser633磷酸化水平降低及细胞内NO产量减少的[17]。PA如何激活PP4,抑制PP4是否可恢复eNOS Ser633磷酸化水平从而恢复内皮细胞功能,本研究开展了深入探讨。
PP4和PP2A有65%的氨基酸序列同源性,对外源性抑制剂福司曲星(fostriecin,FST)敏感[24-25]。因此,首先选用PP4抑制剂FST预处理HUVECs,结果FST可逆转PA诱导的eNOS Ser633磷酸化水平降低和细胞内NO产量减少。其次再运用PP2A催化亚基(PP2Ac)特异性siRNA或PP4催化亚基(PP4c)特异性siRNA转染HUVECs,结果显示,敲低PP2Ac后eNOS Ser633的磷酸化水平无明变化,但敲低PP4c可明显增加eNOS Ser633磷酸化水平。这与本课题组既往报道结果一致[17]。为进一步探讨PA激活PP4的分子机制,运用Western blot方法检测PP4调节亚基PP4R2蛋白表达水平,发现PA显著下调eNOS Ser633磷酸化水平的同时PP4R2蛋白表达水平显著降低。据研究报道,PP4R2是PP4的活性调节亚基,与PP4结合形成聚合体,可负性调控PP4活性[26]。为进一步证实PP4R2调控PP4活性从而调控eNOS Ser633磷酸化水平和内皮细胞功能的作用,本研究构建了慢病毒PP4R2过表达质粒,并转染至HUVECs。结果显示,过表达PP4R2可逆转PA下调的eNOS Ser633磷酸化水平,过表达PP4R2逆转了由PA引起的NO生成降低,恢复内皮细胞迁移能力。已知PA是引起细胞氧化应激的常见因素,因而推测NADPH氧化酶(NAPDH oxidase,Nox)/ROS通路可能参与了PA抑制PP4R2蛋白表达调控。为了证实Nox/ROS通路的作用,首先观察到PA有提高Nox催化亚基gp91phox蛋白表达水平及增加细胞内ROS含量的作用。其次,选用抗氧化剂NAC和APO分别预处理HUVECs,观察到PA诱导的PP4R2蛋白表达降低和eNOS Ser633磷酸化水平降低均明显得到恢复。然后进一步采用gp91phox特异性siRNA转染HUVECs加以证实,结果表明抑制Nox催化亚基gp91phox,可明显逆转PA诱导的PP4R2蛋白表达降低和eNOS Ser633磷酸化水平降低。以上结果表明,PA可通过Nox/ROS通路降低PP4的负性调控亚基PP4R2蛋白表达水平,导致PP4激活,后者可引起eNOS Ser633磷酸化水平降低。
综上所述,游离脂肪酸中最常见的PA可通过增强内皮细胞中Nox催化亚基gp91phox蛋白表达,使Nox酶活性增强,细胞内ROS产量增加,细胞内出现氧化应激反应,抑制PP4的负性调控亚基PP4R2蛋白质表达,导致PP4激活,PP4进而降低eNOS Ser633磷酸化水平,eNOS酶活性降低,内皮细胞产生NO,发生内皮功能障碍。PP4R2蛋白表达被抑制的分子机制以及PP4降低eNOS Ser633磷酸化水平是直接作用还是间接作用还需进一步深入研究。
猜你喜欢亚基统计图磷酸化各式各样的复式条形统计图小学生学习指导(中年级)(2021年5期)2021-05-18心脏钠通道β2亚基转运和功能分析世界最新医学信息文摘(2020年68期)2020-12-25ITSN1蛋白磷酸化的研究进展天津医科大学学报(2019年6期)2019-08-13磷酸化肽富集新方法研究进展分析化学(2017年12期)2017-12-25胰岛素通过mTORC2/SGK1途径上调肺泡上皮钠通道α亚基的作用机制吉林大学学报(医学版)(2015年4期)2015-12-17MAPK抑制因子对HSC中Smad2/3磷酸化及Smad4核转位的影响安徽医科大学学报(2015年9期)2015-12-16如何选择统计图中学生数理化·七年级数学人教版(2014年6期)2014-09-18与统计图有关的判断和说理问题中学生数理化·七年级数学人教版(2014年6期)2014-09-18组蛋白磷酸化修饰与精子发生遗传(2014年3期)2014-02-28小RNA干扰蛋白酶体亚基α7抑制K562细胞增殖中国医学科学院学报(2013年6期)2013-03-11